题目内容
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。
【答案】c(Na+)+c(H+)=2c(CO32—)+c(HCO3—)+c(OH-)Na2CO3+HCl=NaCl+NaHCO3,HCO3—+H2O![]() H2CO3+OH-,HCO3—
H2CO3+OH-,HCO3—![]() H++CO32—,HCCO3—的水解程度大于电离程度2.5×10-6不变9.5×10-9
H++CO32—,HCCO3—的水解程度大于电离程度2.5×10-6不变9.5×10-9
【解析】
(1)根据电荷守恒解答;(2)当V(HCl)=20.00 mL恰好反应生成NaHCO3和NaCl等浓度的混合溶液, 因为溶液中的HCO3-水解程度大于其电离程度,所以溶液呈碱性;(3) V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L,此时溶液PH=5,则溶液中c(H+)=10-5mol/L,若忽略水的电离及H2CO3的第二级电离,则溶液中c(HCO3-)和c(H+)近似相等,再根据电离常数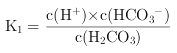 计算;电离平衡常数只受温度影响,温度不变,电离平衡常数不变;(4)计算开始沉淀时C(Ba2+),再根据
计算;电离平衡常数只受温度影响,温度不变,电离平衡常数不变;(4)计算开始沉淀时C(Ba2+),再根据![]() 计算。
计算。
(1)在Na2CO3溶液中,存在平衡:CO![]() +H2O
+H2O![]() HCO
HCO![]() +OH-,HCO
+OH-,HCO![]() +H2O
+H2O![]() H2CO3+OH-,H2O
H2CO3+OH-,H2O![]() H++OH-,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO
H++OH-,根据电荷守恒可得:c(Na+)+c(H+)=c(OH-)+c(HCO![]() )+2c(CO
)+2c(CO![]() )。答案:c(Na+)+c(H+)=2c(CO
)。答案:c(Na+)+c(H+)=2c(CO![]() )+c(HCO
)+c(HCO![]() )+c(OH-)。
)+c(OH-)。
(2)当加入盐酸20.00 mL时,发生反应:Na2CO3+HCl===NaCl+NaHCO3,HCO![]() +H2O
+H2O![]() H2CO3+OH-,HCO
H2CO3+OH-,HCO![]()
![]() H++CO
H++CO![]() ,因HCO
,因HCO![]() 的水解程度大于电离程度,c(H2CO3)>c(CO
的水解程度大于电离程度,c(H2CO3)>c(CO![]() ),使溶液呈碱性。
),使溶液呈碱性。
(3)H2CO3![]() H++HCO
H++HCO![]() ,K1=
,K1=![]() =
=![]() =
=![]() =2.5×10-6,电离常数只与温度有关,温度不变,K1不变。
=2.5×10-6,电离常数只与温度有关,温度不变,K1不变。
(4)Ksp(BaCO3)=c(CO![]() )·c(Ba2+)=0.10×
)·c(Ba2+)=0.10×![]() ≈9.5×10-9。
≈9.5×10-9。