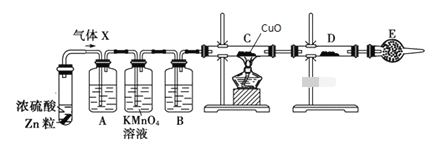
题目内容
【题目】下列反应最终不能生成三价铁的是( )
A.少量Fe与足量稀HNO3反应B.铁丝在硫蒸气中燃烧
C.Fe(OH)2露置于空气中D.向FeBr2溶液中通入足量Cl2
【答案】B
【解析】
A. 少量Fe与足量稀HNO3反应,由于硝酸有强氧化性,故该反应生成硝酸铁,A可以生成三价铁;
B. 硫属于较弱的氧化剂,铁丝在硫蒸气中燃烧生成硫化亚铁,B不能生成三价铁;
C. Fe(OH)2露置于空气中可以被氧化为Fe(OH)3,C可以生成三价铁;
D. 向FeBr2溶液中通入足量Cl2,生成氯化铁和溴,D可以生成三价铁;
综上所述,最终不能生成三价铁的是B。

 名校课堂系列答案
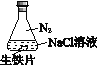
名校课堂系列答案【题目】研究生铁的锈蚀,下列分析不正确的是
序号 | ① | ② | ③ |
实验 |
|
|
|
现象 | 8小时未观察 到明显锈蚀 | 8小时未观察 到明显锈蚀 | 1小时观察 到明显锈蚀 |
A. ①中,NaCl溶液中溶解的O2不足以使生铁片明显锈蚀
B. ②中,生铁片未明显锈蚀的原因之一是缺少H2O
C. ③中正极反应:O2+4e+ 2H2O ==4OH
D. 对比①②③,说明苯能隔绝O2
【题目】硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料。以菱镁矿(主要成分是MgCO3,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的过程如下:
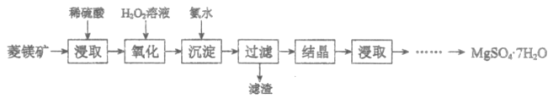
(1)MgCO3溶于稀硫酸的离子方程式是___________。
(2)“氧化”步骤中,加入H2O2溶液的目的是___________(用离子方程式表示)。
(3)“沉淀”步骤中,用氨水调节溶液pH的范围是___________。
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(4)“过滤”所得滤液中含有的阳离子是___________。
【题目】元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑧七种元素在周期表中的位置。
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑤ | ⑥ | ⑧ | |||||
3 | ① | ③ | ④ | ⑦ | ||||
4 | ② |
请回答:
(1)画出③的原子结构示意图_______________
(2)在①、②、③三种元素的最高价氧化物对应水化物中,碱性最强的是_______
(填碱的化学式)。
(3)⑦、⑧两元素对应形成的氢化物中,最稳定的是_____________(填氢化物化学式)。
(4)写出⑤和⑥形成的三原子化合物的化学式____________________
(5)写出①、④元素的最高价氧化物对应水化物之间反应生成的盐的化学式为:______。
【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。