题目内容
【题目】钢铁工业是国家工业的基础,钢铁生锈现象却随处可见,为此每年国家损失大量资金。请回答钢铁腐蚀与防护过程中的有关问题。
(1)钢铁的电化学腐蚀原理如图所示:
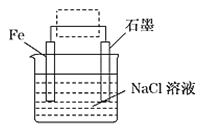
①写出石墨电极的电极反应式____________。
②该装置作简单修改即可成为钢铁电化学防护的装置,请在图虚线框内所示位置作出修改,并用箭头标出导线中电子流动方向____________。
③写出修改后石墨电极的电极反应式________________。
(2)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式_______________________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意如图:

①A电极对应的金属是________(写元素名称),B电极的电极反应式是_______。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为______mol。
【答案】O2+4e-+2H2O=4OH-![]() 2Cl--2e-=Cl2↑2FeCl3+Fe=3FeCl2铜Cu2++2e-=Cu0.08
2Cl--2e-=Cl2↑2FeCl3+Fe=3FeCl2铜Cu2++2e-=Cu0.08
【解析】
(1)①氯化钠溶液呈中性,在中性溶液中钢铁发生吸氧腐蚀,铁易失电子作负极,则石墨作正极,正极上氧气得电子发生还原反应,电极反应式为O2+4e-+2H2O═4OH-,故答案为:O2+4e-+2H2O═4OH-;
②作电解池阴极的铁被保护,所以将虚线中改为直流电源,且将铁连接原电池负极,这属于外加电源的阴极保护法,电子由负极经外电路流向正极,图示为![]() ,故答案为:
,故答案为:![]() ;
;
③外加电源后石墨电极为阳极,阳极上氯离子失电子生成氯气,电极反应式为:2Cl--2e-═Cl2↑,故答案为:2Cl--2e-═Cl2↑;
(2)铁锈的主要成分为氧化铁的水合物,与盐酸反应后生成了Fe3+,而后Fe与Fe3+会化合生成Fe2+,反应方程式为2FeCl3+Fe═3FeCl2,故答案为:2FeCl3+Fe═3FeCl2;
(3)①电镀时,镀层铜作阳极,镀件铁作阴极,所以A是铜,B是铁,阴极上铜离子得电子生成铜,电极反应式为Cu2++2e-═Cu,故答案为:铜;Cu2++2e-═Cu;
②阳极上铜失电子发生氧化反应,阴极上铜离子得电子发生还原反应,若电镀前铁、铜两片金属质量相同,电镀完成后二者质量差为5.12g,二者质量差的一半为阴极析出的铜,则转移电子的物质的量=![]() ×2=0.08mol,故答案为:0.08。
×2=0.08mol,故答案为:0.08。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】常温下向20.00 mL 0.10 mol/L Na2CO3溶液中逐滴加入0.10 mol/L盐酸40.00 mL,所得溶液的pH与加入盐酸体积的关系如表所示:
溶液的pH | 加入盐酸的总体积 |
12 | V(HCl)=0 |
8 | V(HCl)=20.00 mL |
5 | V(HCl)=40.00 mL |
回答下列问题:
(1)20.00 mL 0.10 mol/L Na2CO3溶液中所有阳离子和阴离子的浓度有何关系?______ (用等式表示)。
(2)当V(HCl)=20.00 mL时,溶液呈碱性的原因是________(用离子方程式和必要的文字说明)此时溶液中c(H2CO3)____(填“>”、“<”或“=”)c(CO32—)。
(3)V(HCl)=40.00 mL时,得到H2CO3饱和溶液,且c(H2CO3)=4.0×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
HCO3—+H+的电离常数K1=_____。此时保持其他条件不变,继续加入0.1 mol/L盐酸10.00 mL,K1将_____(填“变大”、“变小”或“不变”)。
(4)若向20 mL 0.10 mol/L Na2CO3溶液中加入BaCl2粉末3.94×10-7 g时开始产生沉淀BaCO3,则Ksp(Ba2CO3)= 。

