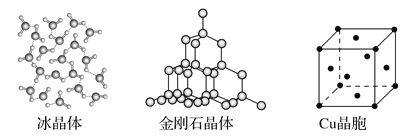
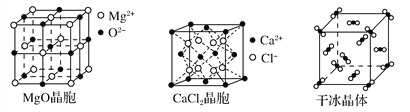
题目内容
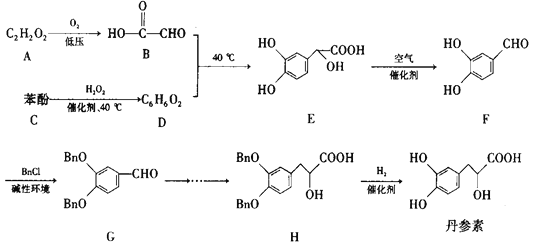
【题目】对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在上述元素中,金属性最强的是___,原子半径最大的是___(0族除外)。
(2)用电子式表示⑦和⑩形成的化合物的过程___。
(3)表中元素构成10电子微粒的分子有:___(任写2种)。
(4)⑤和⑨分别与氢原子构成的简单氢化物中沸点最高的是___。
(5)表中元素⑤和⑦可以形成一种淡黄色物质X,写出X的电子式:___,该物质所含化学键类型___,0.1molX与水反应转移电子数为___。
【答案】Na Na ![]() H2O、CH4、NH3、HF(任意填2个) H2O
H2O、CH4、NH3、HF(任意填2个) H2O ![]() 离子键、共价键 0.1NA
离子键、共价键 0.1NA
【解析】
根据各元素在元素周期表中的位置可知①~⑩号元素分别为H、He、C、N、O、F、Na、Mg、S、Cl。
(1)同周期主族元素自左至右金属性减弱,同主族元素自上而下金属性增强,所以金属性最强的元素为Na;同周期主族元素自左至右原子半径依次减小,同主族元素自上而下原子半径依次增大,所以原子半径最大的元素为Na;
(2)⑦和⑩形成的化合物为NaCl,Na原子失去一个电子形成钠离子,氯原子得到一个电子形成氯离子,钠离子和氯离子结合生成氯化钠,其形成过程为![]() ;
;
(3)表中元素构成10电子微粒的分子有H2O、CH4、NH3、HF;
(4)⑤和⑨分别与氢原子构成的简单氢化物为H2O和H2S,因水分子之间存在氢键,所以水分子的沸点较高;
(5)O元素和Na元素可以形成淡黄色物质Na2O2,其电子式为![]() ;过氧根和钠离子之间为离子键,过氧根中存在氧原子之间的共价键;过氧化钠与水反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,2mol过氧化钠反应时可以生成1mol氧气(氧气为唯一氧化产物,氧元素化合价由-1价到0价),转移2mol电子,所以0.1molX与水反应转移电子数为0.1NA。
;过氧根和钠离子之间为离子键,过氧根中存在氧原子之间的共价键;过氧化钠与水反应的方程式为2Na2O2+2H2O=4NaOH+O2↑,2mol过氧化钠反应时可以生成1mol氧气(氧气为唯一氧化产物,氧元素化合价由-1价到0价),转移2mol电子,所以0.1molX与水反应转移电子数为0.1NA。

【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)①将合成气以n(H2)∶n(CO)=2通入1 L的反应器中,一定条件下发生反应:4H2(g)+2CO(g)![]() CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
CH3OCH3(g)+H2O(g) ΔH,CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是__(填字母)。
A. ΔH<0
B. p1<p2<p3
C. 若在p3和316 ℃时,起始时n(H2)∶n(CO)=3,则达到平衡时,CO转化率小于50%
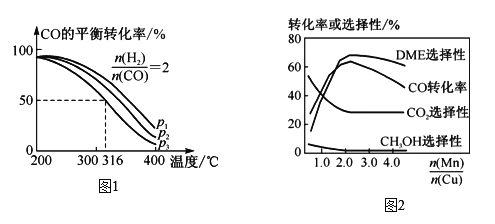
②采用一种新型的催化剂(主要成分是Cu-Mn合金),利用CO和H2制备二甲醚(DME)。观察图2回答问题:催化剂中n(Mn)/n(Cu)约为____时最有利于二甲醚的合成。
(2)CO可用于合成甲醇,反应的化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如图3所示。该反应ΔH_____0(填“>”或“ <”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是______。

(3)在一定条件下,可发生反应6H2(g)+2CO2(g)![]() CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。
500K | 600K | 700K | 800K | |
n(H2)∶n(CO2)=1.5 | 45 | 33 | 20 | 12 |
n(H2)∶n(CO2)=2 | 60 | 43 | 28 | 15 |
n(H2)∶n(CO2)=3 | 83 | 62 | 37 | 22 |
根据上表中数据
①温度一定时,提高氢碳比n(H2)∶n(CO2)],CO2的转化率__(填“增大”、“减小”或“不变”)。
②该反应的正反应为___热反应(填“吸”或“放”)。