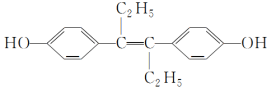
题目内容
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)E元素在周期表中的位置为______________。W、D、E三种元素的简单离子的离子半径由大到小顺序为______________(用离子符号表示)
(2)由A、B、W三种元素组成的18电子微粒的电子式为_____________。
(3)经测定A2W2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式_____________,常用硫酸处理BaO2来制备A2W2,写出该反应的化学方程式_____________。
(4)元素D的单质在一定条件下,能与A单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,该反应的化学方程式为______________。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_______________。
【答案】第三周期IIIA族 O2->Na+>Al3+ ![]() H2O2
H2O2![]() H++HO2- BaO2+H2SO4=BaSO4↓+H2O2 NaH + H2O=NaOH+ H2↑ 3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
H++HO2- BaO2+H2SO4=BaSO4↓+H2O2 NaH + H2O=NaOH+ H2↑ 3Na2O2+6Fe2++6H2O=4Fe(OH)3↓+6Na++2Fe3+
【解析】
A、W能形成两种液态化合物A2W和A2W2,该液态化合物分别为H2O和H2O2,则A为H元素,W为O元素,A、D同主族,则D为Na元素,E元素的周期序数与主族序数相等,且E的原子序数最大,应为第三周期,IIIA族元素,为Al元素,A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,设B的原子序数为x,则有1+x+8+11+13=39,x=6,所以B为C元素,据此回答。
(1)E为Al元素,原子序数为13,原子核外有3个电子层,最外层电子为3,位于周期表第三周期,IIIA族;O2-、Na+、Al3+的电子层结构相同,质子数越多,半径越大,所以W、D、E三种元素的简单离子的离子半径由大到小顺序为O2->Na+>Al3+。
(2)由A、B、W三种元素组成的18电子的粒子为CH3OH,为共价化合物,电子式为![]() 。
。
(3)H2O2为二元弱酸,以第一步电离为主,则电离方程式为H2O2![]() H++HO2-,硫酸处理BaO2来制备H2O2, 还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
H++HO2-,硫酸处理BaO2来制备H2O2, 还有BaSO4生成,反应的化学方程式为BaO2+H2SO4=BaSO4↓+H2O2。
(4)根据上述分析,元素D为Na、A为H元素,Na和氢气在一定条件下化合生成的化合物为NaH,属于离子化合物,NaH能与水反应放氢气,该反应的化学方程式为NaH + H2O=" NaOH" + H2↑。
(5)D的某化合物呈淡黄色,为Na2O2,与氯化亚铁反应的物质的量之比为1:2,且无气体生成,根据质量守恒可知生成物为Fe(OH)3、NaCl和FeCl3,反应的离子方程式为3Na2O2+6Fe2++6H2O= 4Fe(OH)3↓+6Na++2Fe3+。

 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
【题目】对于元素周期表中下列位置的①~⑩十种元素,请回答有关问题(用元素符号或化学式回答)。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | ② | ||||||
2 | ③ | ④ | ⑤ | ⑥ | ||||
3 | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在上述元素中,金属性最强的是___,原子半径最大的是___(0族除外)。
(2)用电子式表示⑦和⑩形成的化合物的过程___。
(3)表中元素构成10电子微粒的分子有:___(任写2种)。
(4)⑤和⑨分别与氢原子构成的简单氢化物中沸点最高的是___。
(5)表中元素⑤和⑦可以形成一种淡黄色物质X,写出X的电子式:___,该物质所含化学键类型___,0.1molX与水反应转移电子数为___。
【题目】硼元素的单质和化合物很多,我们可以利用所学知识认识和理解它们。
(1)硼元素位于元素周期表的__________区;硼元素的价电子排布式为_________。
(2)B、C、Si与H、O原子形成的单键和B、C、Si原子自成单键的键能如下表所示:
化学键 |
|
|
|
|
|
|
|
|
|
键能 | 389 | 411 | 318 | 561 | 358 | 452 | 293 | 346 | 222 |
①自然界中硼主要以含氧化合物的形式存在的原因是_____________。
②类似于烷烃,B、Si也有一系列氢化物,但从物质数量角度看:硅烷<硼烷<烷烃。原因是_________。
③推测晶体B的晶体类型是__________。
(3)乙硼烷![]() 具有强还原性,它和氢化锂反应生成硼氢化锂
具有强还原性,它和氢化锂反应生成硼氢化锂![]() ,硼氢化锂常用于有机合成。
,硼氢化锂常用于有机合成。![]() 由
由![]() 和
和![]() 构成。
构成。![]() 中B原子的杂化轨道类型为_______;
中B原子的杂化轨道类型为_______;![]() 中三种元素电负性由大到小的顺序是__________(写元素符号)。
中三种元素电负性由大到小的顺序是__________(写元素符号)。
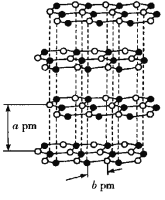
(4)氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到:![]()
①□内物质的空间构型为__________。
②在与石墨结构相似的六方氮化硼晶体中,晶体的层间距为a pm,![]() 键键长为b pm,则六方氮化硼晶体的密度为__________
键键长为b pm,则六方氮化硼晶体的密度为__________![]() (用
(用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
【题目】现有部分短周期元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | 第三电子层(最外层 )上有6个电子 |
X | 核内质子数为6 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
W | 其单质既能跟酸反应,又能跟碱反应,都产生H2 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是_______。
(2)元素Y与氢元素形成一种离子![]() ,写出该微粒的化学式:____(用元素符号表示)。
,写出该微粒的化学式:____(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是____(用元素符号表示 ),下列表述中能证明这一事实的是____(填序号 )。
①常温下Z的单质和T的单质状态不同
②Z的氢化物比T的氢化物稳定
③一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4 )探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应的水化物中化学性质明显不同于其他三种的是____(填化学式 ),理由是____________。Z的最高价氧化物对应的水化物与W的最高价氧化物对应的水化物反应的离子方程式为____。