题目内容
【题目】常温下,一元弱碱甲胺(CH3NH2)的电离常数Kb≈4.0×10-4,lg5≈0.7。电解质溶液的电导率与离子浓度有关,电导率越大,溶液的导电能力越强。常温下,用0.02mol·L-1盐酸分别滴定20.00mL浓度均为0.02mol·L-1的NaOH溶液和CH3NH2溶液,利用传感器测得滴定过程中溶液的电导率如图所示。下列推断正确的是( )
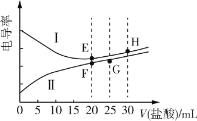
A.曲线Ⅰ代表NaOH的滴定曲线,H点对应的溶液中不存在电离平衡
B.G点对应的溶液中:c(Cl-)>c(H+)>c(CH3NH![]() )>c(OH-)
)>c(OH-)
C.常温下,E、F点对应的溶液中水电离的c(H+)水·c(OH-)水=1.0×10-14
D.常温下,F点对应的溶液的pH≈6.3
【答案】D
【解析】
A.曲线Ⅰ在滴定前电导率较大,说明对应的电解质溶液中离子浓度较大,氢氧化钠溶液和甲胺溶液的起始浓度相等,故曲线Ⅰ代表氢氧化钠的滴定曲线,H点对应的溶液中含有Na+、H+、Cl-、OH-、H2O,存在水的电离平衡,A错误;
B.G点对应的溶液中溶质是CH3NH3Cl、HCl,酸碱中和滴定反应为CH3NH2+HCl=CH3NH3Cl,则过量的HCl的物质的量是CH3NH3Cl的,弱碱阳离子水解程度很小,所以G点对应的溶液中离子浓度大小为c(Cl-)>c(CH3NH![]() )>c(H+)>c(OH-),B错误;
)>c(H+)>c(OH-),B错误;
C.E点对应的溶液为NaCl溶液,呈中性,F点对应的溶液为CH3NH3Cl溶液,呈酸性,CH3NH![]() 水解促进水的电离,故F点对应溶液中水电离的c(H+)·c(OH-)大于水的离子积,C错误;
水解促进水的电离,故F点对应溶液中水电离的c(H+)·c(OH-)大于水的离子积,C错误;
D.F点对应的溶液中酸碱恰好完全反应,溶液中溶质为CH3NH3Cl,浓度为0.01 mol·L-1,溶液中存在水解平衡CH3NH![]() +H2O
+H2O![]() CH3NH2·H2O+H+,Kh=
CH3NH2·H2O+H+,Kh=![]() =
=![]() =2.5×10-11。设0.01 mol·L-1CH3NH3Cl溶液中c(H+)=x mol·L-1,则有
=2.5×10-11。设0.01 mol·L-1CH3NH3Cl溶液中c(H+)=x mol·L-1,则有![]() =2.5×10-11,x≈5×10-7,得溶液的pH≈6.3,D正确;
=2.5×10-11,x≈5×10-7,得溶液的pH≈6.3,D正确;
故选D。

 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案