题目内容
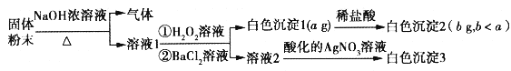
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的 物质的量分数与溶液pH的关系如图乙所示,(已知HA=H++HA- HA- ![]() H++A2-)则下列说法中正确的是( )
H++A2-)则下列说法中正确的是( )

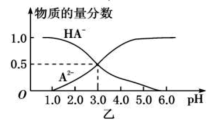
A.pH=3.0时,可以计算出Ka2= 10 -3
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验左边的滴定管为碱式滴定管,用来盛装NaOH溶液,烧杯中并加酚酞作指示剂
D.常温下,将等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
【答案】A
【解析】
A.pH=3时,溶液中HA-和A2-的物质的量分数相等,即c(HA-)=c(A2-),由HA- ![]() H++A2-可知Ka2=
H++A2-可知Ka2=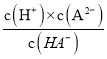 = c(H+)=10-3,故A正确;
= c(H+)=10-3,故A正确;
B.该二元酸第一步完全电离,第二步部分电离,所以NaHA只能电离不能水解,则溶液中不存在H2A,根据物料守恒得c(A2-)+c(HA-)=0.1mol/L,故B错误;
C.该实验左边的滴定管为酸式滴定管,用来盛装H2A溶液,滴定终点时溶液呈碱性,可选取酚酞作指示剂,故C错误;
D.pH=3时,溶液中不存在H2A,说明该酸第一步完全电离,第二步部分电离,则NaHA只电离不水解,Na2A能水解,且c(A2-)=c(HA-);等物质的量浓度的NaHA与Na2A溶液等体积混合,因为电离、水解程度不同导致c(A2-)、c(HA-)不一定相等,则混合溶液的pH不一定等于3,故D错误;
故答案为A。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案
相关题目