题目内容
【题目】葡萄糖酸锌[Zn(C6H11O7)2]是一种有机补锌剂,广泛应用于食药领域。已知葡萄糖酸锌能溶于水,易溶于热水,不溶于乙醇。某小组由葡萄糖制备葡萄糖酸锌的实验步骤如下:
I.制备葡萄糖酸(C6H12O7):
60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min。
II.制备葡萄糖酸钙[Ca(C6H11O7)2]:
将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生。过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用。
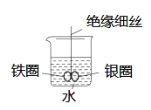
III.制备葡萄糖酸锌粗品(装置如右,夹持、控温装置略):

在90℃水浴、搅拌下,向ZnSO4溶液中分批加入葡萄糖酸钙溶液。趁热过滤,向滤液中加入无水乙醇并冷却析晶,过滤。
请回答下列问题:
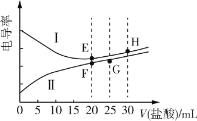
(1) 步骤I中溴水的作用是作______,判断溴水略过量的现象是______。
(2) 步骤II中用CaCl2代替CaCO3可行吗?______ (填“可行”或“不可行”),乙醇可洗去葡萄糖酸钙固体表面杂质,还具有______、______优点。
(3) 步骤III中,恒压滴液漏斗需要打开活塞______ (填“a”、“b”或“a和b”),90℃下,葡萄糖酸钙与硫酸锌发生反应的离子方程式为______。
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,纯化晶体的合理操作顺序是______ (选填写正确序号)。
① 蒸发浓缩至溶液表面出现晶膜;② 待晶体充分析出后,减压过滤;③ 将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;④ 趁热减压过滤,除去不溶物;⑤ 在50℃下用恒温干燥箱烘干,称重;⑥ 取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液。
(5) 测定产品纯度步骤如下:
取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于____中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,用c2mol·L-1 Zn2+标准溶液滴定至终点,发生反应:Zn2++EDTA2—=Zn-EDTA,三次滴定平均消耗锌标准溶液V2mL,则该产品的纯度为______%(保留1个数字系数)。
【答案】氧化葡萄糖变为葡萄糖酸 溶液出现微黄色 不可行 减少固体溶解损失 有利于快速干燥固体 b Ca2++ SO![]() =Ca SO4 ⑥④③②⑤ 锥形瓶
=Ca SO4 ⑥④③②⑤ 锥形瓶 ![]()
【解析】
(1) 葡萄糖是还原性糖,溴具有氧化性,反应后溶液为无色,而溴水为橙色,据此分析解答;
(2) 步骤II中将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生,目的是中和葡萄糖酸;根据物质的溶解性和乙醇的挥发性分析解答;
(3) 步骤III中葡萄糖酸钙与硫酸锌发生反应生成葡萄糖酸锌[Zn(C6H11O7)2]和硫酸钙,结合葡萄糖酸锌Zn(C6H11O7)2能溶于水,书写反应的离子方程式;
(4) 葡萄糖酸锌Zn(C6H11O7)2能溶于水,据此分析葡萄糖酸锌粗品含少量难溶性的杂质的步骤;
(5) 取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,发生反应Zn2++EDTA2- =Zn-EDTA,反应后剩余的Na2EDTA溶液再用c2mol·L-1 Zn2+标准溶液滴定至终点,据此分析计算。
(1) 葡萄糖是还原性糖,溴具有氧化性,步骤I中在60℃水浴下,向一定体积葡萄糖溶液中滴入1%溴水至略过量,保温15 min,溴水可以氧化葡萄糖变为葡萄糖酸,溴水和葡萄糖反应后溶液为无色,而溴水为橙色,因此当看到溶液出现微黄色即可判断溴水已过量,故答案为:氧化葡萄糖变为葡萄糖酸;溶液出现微黄色;
(2) 步骤II中将略过量CaCO3粉末缓慢加入上述溶液,在水浴中振荡,直至无气泡产生,目的是中和葡萄糖酸,因此不能用CaCl2代替CaCO3;过滤,冷却并加入等体积乙醇,产生沉淀。过滤,用乙醇洗涤固体,溶水待用,乙醇可洗去葡萄糖酸钙固体表面杂质,乙醇还具有减少固体溶解损失、有利于快速干燥固体等优点,故答案为:不可行;减少固体溶解损失;有利于快速干燥固体;
(3) 步骤III中,恒压滴液漏斗使用时,只需要打开活塞b;90℃下,葡萄糖酸钙与硫酸锌发生反应生成葡萄糖酸锌[Zn(C6H11O7)2]和硫酸钙,根据题意葡萄糖酸锌Zn(C6H11O7)2能溶于水,因此反应的离子方程式为Ca2++ SO![]() =Ca SO4,故答案为:b;Ca2++ SO
=Ca SO4,故答案为:b;Ca2++ SO![]() =Ca SO4;
=Ca SO4;
(4) 葡萄糖酸锌粗品含少量难溶于水的杂质,分离提纯葡萄糖酸锌晶体,需要取烧杯加入10 mL蒸馏水,加热至微沸,加入粗品,得到葡萄糖酸锌饱和溶液;趁热减压过滤,除去不溶物;将滤液冷却至室温,加入10 mL 95%乙醇溶液并搅拌,促进晶体析出;待晶体充分析出后,减压过滤;在50℃下用恒温干燥箱烘干,称重;因此合理操作顺序为⑥④③②⑤,故答案为:⑥④③②⑤;
(5) 取mg提纯后的产品溶于水配成100mL溶液,取25.00mL置于锥形瓶中,加入V1mLc1mol·L-1Na2EDTA溶液(过量)和指示剂,用c2mol·L-1 Zn2+标准溶液滴定至终点,三次滴定平均消耗c2mol·L-1锌标准溶液V2mL,根据Zn2++EDTA2- =Zn-EDTA,则反应后剩余的EDTA2- 的物质的量为c2mol·L-1×V2L= c2V2×10-3mol,因此原mg提纯后的产品中含有Zn2+的物质的量为(c1V1×10-3mol -c2V2×10-3mol)×![]() ,即葡萄糖酸锌Zn(C6H11O7)2的物质的量为:4c1V1×10-3mol -4c2V2×10-3mol,则该产品的纯度为
,即葡萄糖酸锌Zn(C6H11O7)2的物质的量为:4c1V1×10-3mol -4c2V2×10-3mol,则该产品的纯度为![]() ×100%=
×100%=![]() %,故答案为:锥形瓶;
%,故答案为:锥形瓶;![]() 。
。

【题目】N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2(g)+O2(g)ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/mol/L | 0.50 | 0.35 | 0.25 | 0.25 |
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L