题目内容
3.某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算),现提供的试剂有:a.甲酸钠,b.5mol•L-1硝酸,c.5mol•L-1盐酸,d.5mol•L-1硫酸,e.3%H2O2溶液,f.澄清石灰水.
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2.用稍过量硝酸溶解碳酸钙样品.
步骤3.用石灰水调整溶液pH=5.
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩(蒸发结晶)、趁热过滤、洗涤干燥得甲酸钙晶体.
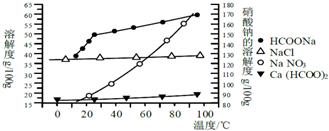
分析 该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出.
步骤2:因工业碳酸钙含杂质为:Al2O3、FeCO3,需用硝酸溶解,因硫酸钙微溶,不能用硫酸溶解,盐酸不具有氧化性,不能氧化亚铁离子;
步骤3:用石灰水调整溶液pH=5,使杂质离子铁离子、铝离子分别生成氢氧化铁、氢氧化铝沉淀除去;
步骤4:通过蒸发结晶,趁热过滤,防止其它晶体析出.
解答 解:该实验首先要去除杂质,同时生成可溶性钙盐,杂质中亚铁离子首先要氧化为铁离子(双氧水或硝酸),再生成氢氧化铁除去,铝离子也要生成碱除去,故调节pH为5(用石灰水调节);然后加入甲酸钠溶液混合生成溶解度较小、随温度变化不明显是甲酸钙,经蒸发浓缩,得到甲酸钙固体,趁热过滤,防止其它晶体析出;
则具体的步骤为:
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用;
硝酸具有强氧化性,不仅能溶解杂质,且能氧化亚铁离子,为下一步将铁离子转化成氢氧化铁沉淀作准备,盐酸盐酸不具有氧化性,不能选用,因硫酸钙微溶,不能用硫酸且稀硫酸不能氧化亚铁重力,所以不选,所以:
步骤2.用稍过量硝酸溶解碳酸钙样品;
氢氧化铁沉淀完全的pH=3.2、氢氧化铝沉沉淀完全的pH=5,调整溶液pH=5,生成氢氧化铁、氢氧化铝沉淀除去,所以:
步骤3.用石灰水调整溶液pH=5;
通过蒸发结晶,趁热过滤,防止其它晶体析出,所以:
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经蒸发浓缩、趁热过滤、洗涤、60℃时干燥得甲酸钙晶体,
故答案为:用稍过量硝酸溶解碳酸钙样品;用石灰水调整溶液pH=5;蒸发浓缩(蒸发结晶);趁热过滤.
点评 本题考查实验方案的设计与评价,涉及实验操作目的、原理、步骤等有关问题,主要考查了实验方案设计中的实验操作,题目难度中等,考查学生的实验探究能力.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案| A. | 酸性高锰酸钾和草酸的反应中,加硫酸锰可大大加快反应速率 | |
| B. | 硫代硫酸钠和硫酸的反应中有硫和二氧化硫产生 | |
| C. | 同一反应,不同催化剂的催化效果不一样 | |
| D. | H2O2的分解的方程式:H2O2$\frac{\underline{\;MnO_2\;}}{\;}$ H2↑+O2↑ |
| A. | 为防止试管破裂,加热固体时试管口一般要略高于试管底 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 | |
| C. | 不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 | |
| D. | 酒精灯着火时用湿抹布盖灭 |
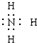 .
.


 的系统命名:3,4-二甲基已烷;
的系统命名:3,4-二甲基已烷; 的键线式:
的键线式: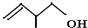 .
.