题目内容
1.某温度下,在0.1mol•L-1的NaHB强电解质溶液中,c(H+)>c(OH-),则下列关系式一定正确的是( )| A. | .c(Na+)=c(HB-)+2c(B2-)+c(OH-) | B. | .c(Na+)=0.1mol•L-1≥c(B2-) | ||
| C. | .c(H+)•c(OH-)=10-14 | D. | 此溶液的pH=1 |
分析 在浓度为0.1mol/L的NaHB溶液中,若c(H+)>(OH-),说明HB-电离程度大于水解程度,溶液呈酸性,结合电荷守恒解答该题.
解答 解:A.溶液存在电荷守恒,应为c(Na+)+c(H+)=c(HB-)+2c(B2-)+c(OH-),故A错误;
B.c(Na+)=0.1mol•L-1,如HB-完全电离,则c(B2-)=0.1 mol/L,如HB-部分电离,则c(B2-)<0.1 mol/L,.c(Na+)=0.1mol•L-1≥c(B2-),故B正确;
C.温度不一定为常温下,则离子积常数不一定为10-14,故C错误;
D.0.1mol/L的NaHB溶液,不能说明HB-是否完全电离,则溶液pH≥1,故D错误;
故选B.
点评 本题考查离子浓度大小比较,侧重于弱电解质的电离和盐类水解的考查,为考高常见题型,难度不大,注意把握盐类水解的原理和规律,答题时注意仔细审题.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
11.下列物质中能使酸性高锰酸钾溶液褪色的是( )
| A. | 乙烷 | B. | 乙烯 | C. | 乙醇 | D. | 乙酸 |
12.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )
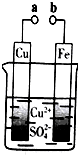

| A. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| B. | a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动 | |
| C. | a和b不连接时,铁片上会有金属铜析出 | |
| D. | a和b用导线连接时,外电路中每通过0.1mol电子,铜的质量理论上增加3.2g |
9.下列说法中,正确的是( )
| A. | 乙烯使溴水褪色,乙醇使酸性KMnO4溶液褪色,两者化学反应类型相同 | |
| B. | 1mol乙烯和Cl2完全加成后,再与Cl2彻底取代,两过程共消耗5mol Cl2 | |
| C. | 化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示 | |
| D. | 共价化合物中一定含有共价键,可能含有离子键 |
6.下列变化或应用中,与分子间作用力有关的是( )
| A. | 氯化钠晶体溶于水 | B. | 硝酸钾晶体的熔化、冷却 | ||
| C. | 次氯酸用于杀菌消毒 | D. | 夏天马路洒水降温 |
13.下列有关认识正确的是( )
| A. | 1s电子云呈球形,表示电子绕原子核做圆周运动 | |
| B. | 各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7 | |
| C. | 各能层含有的能级数为n-1 (n代表能层序数) | |
| D. | 各能层含有的电子数为2n2(n代表能层序数) |
10.小明体检的血液化验单中葡萄糖为5.9×10-3mmol/L.这里的“mmol/L”是指( )
| A. | 物质的量 | B. | 物质的量浓度 | C. | 质量百分含量 | D. | 物质的摩尔质量 |
11.常温下在下列给定条件的溶液中,能大量共存的粒子组是( )
| A. | 能使pH试纸呈红色的溶液:CH3COOH、NH4+、I-、NO3- | |
| B. | pH=14的溶液:Ba2+、Mg2+、HCO3- | |
| C. | c(Fe3+)=0.1mol/L的溶液:H+、Al3+、Cl-、SCN- | |
| D. | kw/c(H+)=0.1mol/L的溶液:Na+、NH3•H2O、SiO32-、NO3- |
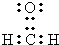 .A中所有原子是否共面是(填“是”或“否”).
.A中所有原子是否共面是(填“是”或“否”).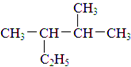 :2,3-二甲基戊烷;②
:2,3-二甲基戊烷;②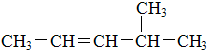 :4-甲基-2-戊烯.
:4-甲基-2-戊烯.