��Ŀ����
����Ŀ����ҵ������Ĺؼ��ǰ��Ĵ������������Ṥҵ��صĹ����в����ĵ�������NOx(NO��NO2�Ļ������費��N2O4)�Ĵ�����Ӧ��Ҳ�ǿ�ѧ�о����ȵ㡣
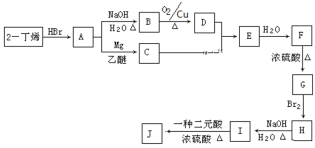
�Ź�ҵ�Ͽ��ð������շ�����NOx����Ӧԭ��Ϊ4xNH3+6NOx![]() (2x+3)N2+6xH2O��ij��ѧ��ȤС��ģ��ô������̵�ʵ��װ����ͼ��ʾ��
(2x+3)N2+6xH2O��ij��ѧ��ȤС��ģ��ô������̵�ʵ��װ����ͼ��ʾ��
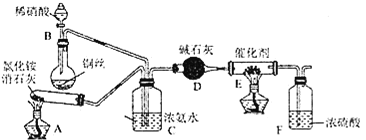
��װ��A�з�����Ӧ�Ļ�ѧ����ʽΪ________��
��װ��D�м�ʯ�ҵ�������________��
�ƹ�ҵ��Ҳ����Na2CO3��Һ���շ�����NOx(��֪��NO������Na2CO3��Һ��Ӧ)��NO+NO2+ Na2CO3 = 2 NaNO2+ CO2��
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2��
�ٵ�NOx��Na2CO3��Һ��ȫ����ʱ��x��ֵ��������________![]() ��ѡ����ĸ
��ѡ����ĸ![]() ��
��
A.1.4 B.1.6 C.1.8
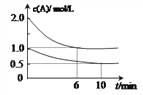
�ڽ�1 mol NOxͨ��Na2CO3��Һ�У�����ȫ����ʱ����Һ�����ɵ�NO3����NO2���������ӵ����ʵ�����x�仯��ϵ��ͼ��ʾ��
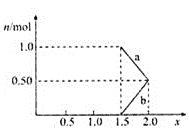
ͼ���߶�a��ʾ________![]() �ѧʽ
�ѧʽ![]() ��xֵ�ı仯��ϵ������������������Ϊ21.2%��Na2CO3��Һ���գ�����ҪNa2CO3��Һ����________g��
��xֵ�ı仯��ϵ������������������Ϊ21.2%��Na2CO3��Һ���գ�����ҪNa2CO3��Һ����________g��
![]() ��������Na2CO3��Һ��ȫ����NOx��ÿ����22.4 L(��״��)CO2(ȫ���ݳ�)ʱ������Һ����������44g����NOx�е�
��������Na2CO3��Һ��ȫ����NOx��ÿ����22.4 L(��״��)CO2(ȫ���ݳ�)ʱ������Һ����������44g����NOx�е�![]() ________��
________��
�ǰ������շ���Na2CO3��Һ���շ�����NOxβ����������________��
������Ҳ���������մ���NOx���䷴Ӧԭ��ΪNO+NO2+ H2O = 2HNO2��2HNO2+CO(NH2)2 = 3H2O + CO2��+ 2N2���������������NO��NO2��������Ӧ��ϵ����ʱ����Ч����ѡ������������V(NO):V(NO2)=5:1ʱ����ͨ��һ�����Ŀ�����ͬ��ͬѹ�£�V(����):V(NO)= ________ (������O2���������ԼΪ20%)��
���𰸡�2NH4Cl+Ca(OH)2![]() CaCl2 + 2NH3�� +2H2O ��ȥ�����к��е�ˮ���� A NO2�� 250 1.875 ���ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ
CaCl2 + 2NH3�� +2H2O ��ȥ�����к��е�ˮ���� A NO2�� 250 1.875 ���ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ ![]() ��1
��1
��������
�Ţ�A���Ȼ�������������ڼ��������·�Ӧ���ɰ������Ȼ��ƺ�ˮ�õ�����ʽ��
�ڼ�ʯ��Ϊ���Ը���������Ը������������������塣
�Ƣ��ɷ���ʽ��֪��NO�������ܱ����գ�NO��NO2������屻NaOH��Һ����ȫ���գ�����n(NO2):n(NO)��1���ٽ��м�����Сֵ��
�ڸ��ݼ������㣬NO��NO2���ʵ�����Ϊ1��1��ֻ����NO2�����ٸ����غ㷨���м��㡣
������δ֪�����ݷ���ʽ���м��㣬�õ��������ʵ������������ʵ������ټ���NOx��
�ǵ��������ж�������ô������յ��������ܽ��ж�����ת��Ϊ�����ʡ�
�������������V(NO):V(NO2)=5:1ʱ������NOΪ5mol��NO2Ϊ1mol��Ϊʹ���屻��ȫ���գ�Ӧ����NOΪ3mol��NO2Ϊ3mol�����ݷ���ʽҪ��NOת��ΪNO2����Ҫ����������ת��Ϊ������
�Ţ�A���Ȼ�������������ڼ��������·�Ӧ���ɰ������Ȼ��ƺ�ˮ������ʽΪ��2NH4Cl+Ca(OH)2![]() CaCl2 + 2NH3�� +2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2
CaCl2 + 2NH3�� +2H2O���ʴ�Ϊ��2NH4Cl+Ca(OH)2![]() CaCl2 + 2NH3�� +2H2O��
CaCl2 + 2NH3�� +2H2O��
�ڼ�ʯ��Ϊ���Ը����������Ϊ�������壬���Կ����ü�ʯ�Ҹ��ﰱ�����ʴ�Ϊ����ȥ�����к��е�ˮ������
�Ƣ��ɷ���ʽ��֪��NO�������ܱ����գ�NO��NO2������屻NaOH��Һ����ȫ���գ�����n(NO2):n(NO)��1����n(NO2):n(NO)=1ʱxֵ��С��x��СֵΪ![]() ����Ϊ����NO������x���ֵ
����Ϊ����NO������x���ֵ![]() ����x��ȡֵ��ΧΪ1.5��x<2������x��ֵ��������1.3���ʴ�Ϊ��A��
����x��ȡֵ��ΧΪ1.5��x<2������x��ֵ��������1.3���ʴ�Ϊ��A��
���ü�������x=1.5����ӦΪNO��NO2�������ʵ�����Ϊ1��1����NO+NO2+ Na2CO3 = 2 NaNO2+ CO2��Ӧ��û��NO3������aӦ�ñ�ʾNO2�������غ㷨��֪����Ӧ���ɵ�NaNO3��NaNO2�е�Ԫ������Ԫ��֮��Ϊ1��1������1molNOx����ȫ����������̼����0.5mol������Ϊ53g������̼������Һ������Ϊ![]() ���ʴ�Ϊ��NO2����250��
���ʴ�Ϊ��NO2����250��
������NO2�ʹ��Ӧ����CO2Ϊamol��
��NO��NO2�봿�Ӧ������CO2Ϊbmol��
2NO2+ Na2CO3 = NaNO2+ NaNO3+ CO2 ����������m=48g
1mol 48g
Amol 48ag
NO+NO2+ Na2CO3 = 2 NaNO2+ CO2 ����������m=32g
1mol 32g
bmol 32bg
a + b =1��48a + 32b = 44�����a= 0.75mol��b = 0.25mol
n(NO2)=0.75mol��2 +0.25mol =1.75mol
n(NO)=0.25mol��
![]() ���ʴ�Ϊ��1.875��
���ʴ�Ϊ��1.875��
�ǵ��������ж����Ի�������Ⱦ���ô������յ��������ܽ��ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ���ʴ�Ϊ�����ж�����ת��Ϊ�����ʣ���ֹ�ж��������Ⱦ��
�������������V(NO):V(NO2)=5:1ʱ������NOΪ5mol��NO2Ϊ1mol��Ϊʹ���屻��ȫ���գ�Ӧ����NOΪ3mol��NO2Ϊ3mol�����跴Ӧ2molNO����NO2���ɷ���ʽ2NO +O2 =2NO