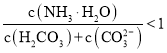题目内容
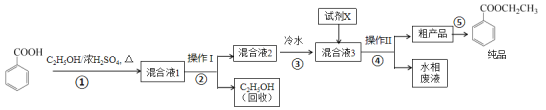
【题目】苯甲酸乙酯是重要的精细化工试剂,常用于配制水果型食用香精。实验室制备流程如下:
试剂相关性质如下表:
苯甲酸 | 乙醇 | 苯甲酸乙酯 | |
常温性状 | 白色针状晶体 | 无色液体 | 无色透明液体 |
沸点/℃ | 249.0 | 78.0 | 212.6 |
相对分子量 | 122 | 46 | 150 |
溶解性 | 微溶于水,易溶于乙醇、乙醚等有机溶剂 | 与水任意比互溶 | 难溶于冷水,微溶于热水,易溶于乙醇和乙醚 |
回答下列问题:
(1)为提高原料苯甲酸的纯度,可采用的纯化方法为_________。
(2)步骤①的装置如图所示(加热和夹持装置已略去),将一小团棉花放入仪器B中靠近活塞孔处,将吸水剂(无水硫酸铜的乙醇饱和溶液)放入仪器B中,在仪器C中加入 12.2 g纯化后的苯甲酸晶体,30 mL无水乙醇(约0.5 mol)和3 mL浓硫酸,加入沸石,加热至微沸,回流反应1.5~2 h。仪器A的作用是_________;仪器C中反应液应采用_________方式加热。
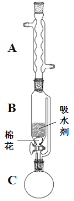
(3)随着反应进行,反应体系中水分不断被有效分离,仪器B中吸水剂的现象为_________。
(4)反应结束后,对C中混合液进行分离提纯,操作I是_________;操作II所用的玻璃仪器除了烧杯外还有_________。
(5)反应结束后,步骤③中将反应液倒入冷水的目的除了溶解乙醇外,还有_____;加入试剂X为_____(填写化学式)。
(6)最终得到产物纯品12.0 g,实验产率为_________ %(保留三位有效数字)。
【答案】重结晶 冷凝回流乙醇和水 水浴加热 吸水剂由白色变为蓝色 蒸馏 分液漏斗 降低苯甲酸乙酯的溶解度利于分层 Na2CO3或NaHCO3 80.0
【解析】
苯甲酸与乙醇在浓硫酸作催化剂发生酯化反应生成苯甲酸乙酯,苯甲酸乙酯与乙醇和苯甲酸能够混溶,苯甲酸乙酯与乙醇沸点差异较大,因此操作I为蒸馏,混合液2中主要成分为苯甲酸乙酯和苯甲酸,加入试剂X除去苯甲酸,因此可选择试剂饱和碳酸钠进行除杂,然后分液制备粗产品,然后通过干燥制备苯甲酸乙酯纯品,以此解答本题。
(1)可通过重结晶的方式提高原料苯甲酸的纯度;
(2)仪器A为球形冷凝管,在制备过程中乙醇易挥发,因此通过球形冷凝管冷凝回流乙醇和水;该反应中乙醇作为反应物,因此可通过水浴加热,避免乙醇大量挥发;
(3)仪器B中吸水剂为无水硫酸铜的乙醇饱和溶液,吸收水分后生成五水硫酸铜,吸水剂由白色变为蓝色;
(4)由上述分析可知,操作I为蒸馏;操作II为分液,除烧杯外,还需要的玻璃仪器为分液漏斗;
(5)因苯甲酸乙酯难溶于冷水,步骤③中将反应液倒入冷水的目的还有降低苯甲酸乙酯的溶解度有利于分层;试剂X为Na2CO3溶液或NaHCO3溶液;
(6)12g苯甲酸乙酯的物质的量为![]() ,苯甲酸的物质的量为
,苯甲酸的物质的量为![]() ,反应过程中乙醇过量,理论产生苯甲酸乙酯的物质的量为0.1mol,实验产率为
,反应过程中乙醇过量,理论产生苯甲酸乙酯的物质的量为0.1mol,实验产率为![]() 。
。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】氢气和二氧化碳在一定条件下可合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
I、在恒温条件下,分别将2 molCO2和6 mol H2充入一个固定容积为1L的密闭容器中,随着反应的进行,气体混合物中n(H2)、n(CH3OH)与反应时间t的关系如下表;
t/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
n(H2)/mol | 6.00 | 4.50 | 3.60 | 3.30 | 3.03 | 3.00 | 3.00 |
n(CH3OH)/mol | 0 | 0.50 | 0.80 | 0.90 | 0.99 | 1.00 | 1.00 |
(1)前10min中利用CO2表示的反应速率为____________。
(2)该温度下,此反应的平衡常数K=__________。
(3)该温度下,若向同容积的另一容器中投入的:CO2、H2、CH3OH、H2O的浓度分别为2 mol·L-1、2 mol·L-1、1 mol·L-1、1 mol·L-1,则此时v正_______v逆(填“>”、“<”或“=”)。
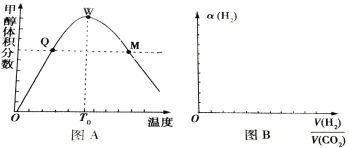
Ⅱ、在密闭容器中充入1molCO2和3 mol H2,测得混合气体中甲醇的体积分数与温度的关系如图A所示:
试回答下列问题:
(1)该反应是______(填“放热”或“吸热”)反应。
(2)氢气在Q点的转化率_________(填“大于”、“小于”或“等于”,下同)氢气在W点的转化率;
(3)解释0—T0内,甲醇的体积分数变化趋势:_______________。
(4)图B表示氢气转化率α(H2)与投料比![]() 的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
的关系,请在图B中画出两条变化曲线并标出曲线对应的条件,两条曲线对应的条件分别为:一条曲线对应的压强是1.01×105Pa;另一条曲线对应的压强是3.03×105Pa(其它条件相同)________。
【题目】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①HCOONa、NaCN、NaHCO3、Na2CO3这四种溶液的阴离子结合质子能力最强的是______。
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.H2SO4分别与浓度相等的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填序号)_____。
③向NaCN溶液通入少量CO2反应的化学方程式是_______。
(2)一定浓度的NaCN溶液pH=9,用离子方程式表示呈碱性的原因是____,此时, =_____。
=_____。
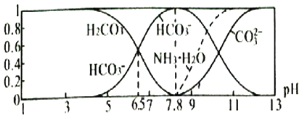
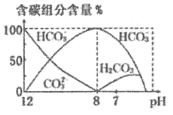
(3)常温下,向20 mL 0.1 mol/L Na2CO3溶液中逐滴加入0.1 mol/L HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
在同一溶液中H2CO3、![]() 、
、![]() ______(填“能”或“不能”)大量共存。
______(填“能”或“不能”)大量共存。
②当pH=7时,溶液中含碳元素的主要微粒为_____,溶液中各种离子(![]() 除外)的物质的量浓度的大小关系为______。
除外)的物质的量浓度的大小关系为______。
③已知在25℃时,![]() 水解反应的平衡常数即水解常数Kh=
水解反应的平衡常数即水解常数Kh=![]() =2.0×10-4,当溶液中c(
=2.0×10-4,当溶液中c(![]() ):c(
):c(![]() )=2:1时,溶液pH=______。
)=2:1时,溶液pH=______。
(4)已知CaCO3的Ksp=2.8×10-9,现将浓度为2×10-4 mol/L Na2CO3溶液与CaCl2溶液等体积混合,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为________mol/L。