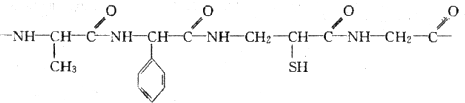
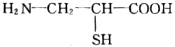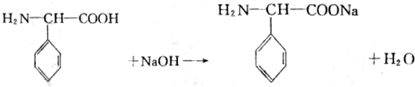题目内容
11.下列物质中,属于含有极性共价键的离子化合物的是( )| A. | MgCl2 | B. | Br2 | C. | KOH | D. | CH3COOH |
分析 活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.氯化镁中镁离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.溴分子中Br-Br原子之间只存在非极性键,且属于单质,故B错误;
C.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在极性键,为离子化合物,故C正确;
D.乙酸分子中C-C、C-O、C-H、O-H原子之间只存在共价键,为共价化合物,故D错误;
故选C.
点评 本题考查化学键和化合物的关系,明确物质中存在微粒及微粒之间作用力即可解答,注意不能根据是否含有金属元素判断离子键及离子化合物,为易错点.

练习册系列答案
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案
相关题目
2. 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应为放热反应(填“吸”或“放”);
(2)镁带燃烧的现象是放热,发出耀眼白光,有白烟,镁带的作用是燃烧时提供热量,引发反应;
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
同学们分析数据后推测该熔融物是一种合金,其中的金属是Al、Fe,溶解该合金可选用下列试剂中的BC(填序号).
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
 研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:
研究性学习小组的同学们用如图所示装置进行铝热反应的实验,请回答:(1)氧化铁与铝反应的化学方程式是2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,该反应为放热反应(填“吸”或“放”);
(2)镁带燃烧的现象是放热,发出耀眼白光,有白烟,镁带的作用是燃烧时提供热量,引发反应;
(3)同学们在实验过程中观察到纸漏斗的下部被烧穿,有熔融物落入沙中.他们为探究此熔融物的成分,查阅(化学手册)得知有关物质的熔点、沸点数据如下:
| 物质 | Al | Al2O3 | Fe | Fe2O3 |
| 熔点/℃ | 660 | 2054 | 1535 | 1462 |
| 沸点/℃ | 2467 | 2980 | 2750 | - |
A.FeSO4溶液 B.稀硫酸 C.稀硝酸 D.NaOH溶液.
6.表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
(1)9种元素中,化学性质最不活泼的是Ne,还原性最强的单质是Na.(用元素符号表示).
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式: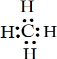
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(2)③与⑧分别与氢形成的化合物沸点较高的是H2O(用化学式表示).
(3)请写出①与②元素形成的最简单的有机物的电子式:
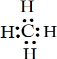
(4)④与⑨两种元素非金属性强弱顺序为:⑨<④(填“>”或“<”或“=”)
(5)⑥、⑦、⑧、⑨四种元素形成的简单离子中,离子半径最大的是S2-(用元素符号表示).
(6)⑦与⑥的最高价氧化物对应的水化物反应的化学反方程式2Al+2NaOH+2H2O=2NaAlO2+3H2↑.
16.下列关于化石燃料煤、石油和天然气的说法中,不正确的是( )
| A. | 石油是多种碳氢化合物的混合物,可据各组分沸点不同进行分馏利用 | |
| B. | 煤的气化、液化是物理变化,煤的干馏是化学变化 | |
| C. | 天然气的主要成分是甲烷 | |
| D. | 酸雨形成的主要原因是含硫化石燃料的大量燃烧 |
 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.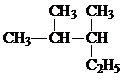 2,3-二甲基戊烷.
2,3-二甲基戊烷. 表示的分子式为C6H14;名称是2-甲基戊烷.
表示的分子式为C6H14;名称是2-甲基戊烷. 中含有的官能团的名称为羟基、酯基.
中含有的官能团的名称为羟基、酯基.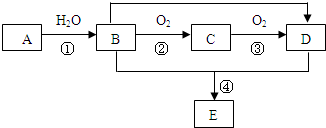
 CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应).
CH3COOCH2CH3+H2O,反应类型为酯化反应(或取代反应). ;
;