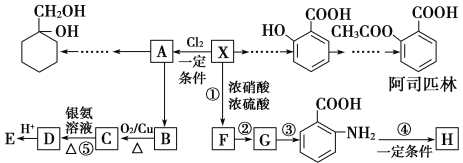
题目内容
【题目】常温下,向20mL0.1moL/L的H3PO4溶液中滴加0.1moL/L的 NaOH溶液,所得溶液的pH与NaOH溶液体积的关系如图所示,下列说法正确的是

A. H3PO4溶液第一步滴定可用酚酞作指示剂
B. A点溶液中c(H2PO4-)>c(H3PO4)>c(HPO42-)
C. 图像中A、B、C三处溶液中![]() 相等
相等
D. B点溶液存在2c(Na+)=c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)
【答案】C
【解析】
A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂;
B、NaH2PO4在水溶液中,电离大于水解;
C、温度相同,同一反应的平衡常数相同;
D、B点是Na2HPO4溶液,用物料守恒去解。
A、H3PO4溶液第一步滴定生成NaH2PO4,溶液呈酸性,选变色范围为酸性的指示剂,可选用甲基橙作指示剂,故A错误;
B、A点为NaH2PO4溶液,NaH2PO4在水溶液中,电离大于水解,A点溶液中c(H2PO4-)>c(HPO42-)>c(H3PO4),故B错误;
C、温度相同,同一反应的平衡常数相同,HPO42-水解常数:A、B、C三处溶液中![]() 相等,故C正确;
相等,故C正确;
D、B点是Na2HPO4溶液,物料守恒为:c(Na+)=2[c(PO43-)+c(H2PO4-)+c(HPO42-)+c(H3PO4)],故D错误。
故选C。

【题目】T ℃时,在容积为2 L的3个恒容密闭容器中发生反应:3A(g)+B(g)![]() nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
nC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 |
反应物的投入量 | 3 mol A、2 mol B | 6 mol A、4 mol B | 2 mol C |
达到平衡的时间/min | 5 | 8 | |
A的浓度/mol·L-1 | c1 | c2 | |
C的体积分数% | w1 | w3 | |
混合气体的密度/g·L-1 | ρ1 | ρ2 |
下列说法正确的是( )
A. 若n<4,则2c1<c2
B. 若n=4,则w3=w1
C. 无论n的值是多少均有2ρ1=ρ2
D. 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
【题目】中和热的测定是高中化学中重要的定量实验。取50mL、0.55mol/L的NaOH溶液与50mL、0.25mol/L的H2SO4溶液置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(1)从如图所示实验装置看,其中尚缺少的一种玻璃用品是_____________,除此之外,装置的一个明显错误是___________________________________________________。

(2)NaOH溶液稍过量的原因是_______________________________________________。
(3)若改用60mL、0.25mol/L的H2SO4溶液和50mL、0.55mol/L的NaOH溶液进行反应,与上述实验相比,所放出的热量_____________(填“相等”或“不相等”),若实验操作均正确,则所求中和热_______________(填“相等”或“不相等”)。
(4)倒入NaOH溶液的正确操作是__________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次性迅速倒入
(5)实验数据如下表:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①近似认为0.55mol/L NaOH溶液和0.25mol/L H2SO4溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),则中和热△H=__________(取小数点后一位)。
②上述实验的结果与57.3kJ/mol有偏差,产生偏差的原因可能是____________。
A.实验装置保温、隔热效果差
B.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
C.做实验的当天室温较高
D.量取H2SO4时仰视读数