题目内容
【题目】有A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同;A、B可形成离子化合物B2A;C的原子结构示意图为: ,D的最外层电子数是电子层数的2倍。试回答下列各问题:
,D的最外层电子数是电子层数的2倍。试回答下列各问题:
(1)A的阴离子的结构示意图为_____________;
(2)C元素位于元素周期表中第________周期、第_______族;
(3)化合物B2A的电子式为______________;
(4)已知:D的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为_________________。
【答案】![]() 3 ⅣA
3 ⅣA ![]() S + 2H2SO4(浓)
S + 2H2SO4(浓)![]() 3SO2↑ + 2H2O
3SO2↑ + 2H2O
【解析】
A、B、C、D四种元素的原子序数依次增大,B的阳离子与A的阴离子和氖原子的电子层结构相同,说明B为第三周期元素,A为第二周期元素;A、B可形成离子化合物B2A,则B为Na元素,A为O元素;C的原子结构示意图为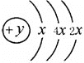 ,则x=2,所以C为硅元素;D的最外层电子数是电子层数的2倍,原子序数大于14,则D为S元素,据此分析解答。
,则x=2,所以C为硅元素;D的最外层电子数是电子层数的2倍,原子序数大于14,则D为S元素,据此分析解答。
根据上述分析,A为O元素,B为Na元素,C为硅元素,D为S元素。
(1)氧为8号元素,其阴离子的结构示意图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)C为硅元素,位于元素周期表中第3周期、第ⅣA族,故答案为:3;ⅣA;
(3)化合物B2A为氧化钠,是离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)S的最高价氧化物的水化物为硫酸,硫单质与浓硫酸共热发生氧化还原反应,生成二氧化硫和水,反应的化学方程式为S + 2H2SO4(浓)![]() 3SO2↑ + 2H2O,故答案为:S + 2H2SO4(浓)
3SO2↑ + 2H2O,故答案为:S + 2H2SO4(浓)![]() 3SO2↑ + 2H2O。
3SO2↑ + 2H2O。

练习册系列答案
相关题目



