题目内容
【题目】已知常温下,酸性:HF>HCN,分别向1L1mol/L的HF和HCN溶液中加NaOH固体调节pH(忽略温度和溶液体积的变化),溶液中的(X表示F或CN)随pH变化如图所示,下列说法正确的是
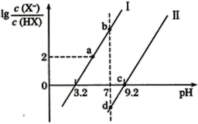
A.HF的电离常数Ka(HF)的数量级10-4
B.d点溶液中:c(Na+)=c(X-)>c(HX)
C.a到b点的过程中水的电离程度先变大后变小
D.b点溶液和d点溶液中c(Na+):b<d
【答案】A
【解析】
已知酸性:HF>HCN,则Ka(HF)>Ka(HCN),即:![]() ,当
,当![]() 相同时HF中c(H+)>HCN中c(H+),此时HF的pH小于HCN,所以直线Ⅰ表示HF溶液中加NaOH的变化情况,直线Ⅱ表示HCN溶液中加NaOH的变化情况。
相同时HF中c(H+)>HCN中c(H+),此时HF的pH小于HCN,所以直线Ⅰ表示HF溶液中加NaOH的变化情况,直线Ⅱ表示HCN溶液中加NaOH的变化情况。
A.根据直线Ⅰ的坐标(3.2,0)可以计算出Ka(HF)的值,Ka(HF)=c(H+)=10-3.2=100.8×10-4,所以其数量级为10-4,A正确;
B.d点溶液呈中性,由电荷守恒c(Na+)+c(H+)=c(CN-)+c(OH-)可得到:c(Na+)=c(CN-),又由图可知:![]() ,所以d点溶液中:c(HX)>c(Na+)=c(X-),B错误;
,所以d点溶液中:c(HX)>c(Na+)=c(X-),B错误;
C.a到b点的过程中,HF不断减少,但未反应完,H2O的电离程度逐渐增大,C错误;
D.b、d两点溶液均呈中性,b溶液中溶质:NaF和HF,d溶液中溶质:NaCN和HCN,但CN-水解程度大于F-,要使产生的OH-离子浓度相同,NaCN浓度必定小一些,所以有b点溶液和d点溶液中c(Na+):b>d,D错误;
答案选A。

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目