题目内容
【题目】一定量的氢气在氯气中燃烧,所得混合物用100ml 3.0mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
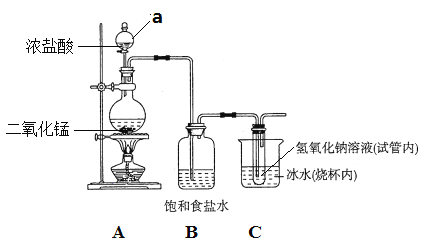
(1)写出实验室制氯气的化学方程式_______________________________,氧化剂与还原剂的物质的量之比为 ________。
(2)氯气与氢氧化钠溶液反应的离子方程式为 _______________________________ 。
(3)所得溶液中Cl-的物质的量为_____________mol。
(4)原混合物中氯气和氢气的物质的量之比为_____________。
【答案】MnO2 +4HCl(浓) ![]() MnCl2 +Cl2↑+2H2O 1:2 Cl2+2OH-=Cl-+ClO-+H2O 0.25 3:2
MnCl2 +Cl2↑+2H2O 1:2 Cl2+2OH-=Cl-+ClO-+H2O 0.25 3:2
【解析】
实验室利用MnO2和浓盐酸制取Cl2,Cl2与NaOH 溶液反应生成NaCl和NaClO,由题意可知氯气过量,反应后混合物为HCl和Cl2,涉及反应有HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,根据质量守恒计算。
(1)实验室利用MnO2和浓盐酸制取Cl2,其化学方程式:MnO2 +4HCl(浓) ![]() MnCl2 +Cl2↑+2H2O,氧化剂为MnO2、还原剂为HCl,其物质的量之比为:1:2;故答案为:MnO2 +4HCl(浓)
MnCl2 +Cl2↑+2H2O,氧化剂为MnO2、还原剂为HCl,其物质的量之比为:1:2;故答案为:MnO2 +4HCl(浓) ![]() MnCl2 +Cl2↑+2H2O、1:2;
MnCl2 +Cl2↑+2H2O、1:2;
(2)Cl2与NaOH 溶液反应生成NaCl和NaClO,其离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)所得溶液中为NaCl和NaClO的混合物,根据电荷守恒n(Na+)=n(Cl-)+n(ClO-),则n(Cl-)=n(Na+)-n(ClO-)=0.3mol-0.05mol=0.25mol,故答案为:0.25;
(4)由题意可知氯气过量,反应后所得混合物为HCl和Cl2,涉及反应:HCl+NaOH=NaCl+H2O、Cl2+2NaOH=NaCl+NaClO+H2O,据反应可知,燃烧后剩余Cl2为n(Cl2)余=n(NaClO)=0.05 mol,与H2反应的Cl2为n(Cl2)=![]() ×[n(Cl-)-n(NaClO)]=
×[n(Cl-)-n(NaClO)]=![]() ×(0.25mol-0.05mol)=0.1mol=n(H2),则原混合物中氯气和氢气的物质的量之比
×(0.25mol-0.05mol)=0.1mol=n(H2),则原混合物中氯气和氢气的物质的量之比
n(Cl2):n(H2)=(0.1mol+0.05mol):0.1mol=3:2,故答案为:3:2。