题目内容
15.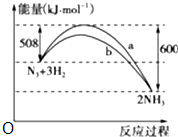 常温下,体积相同pH相同的盐酸和醋酸,同时加入足量表面积相同的锌粒,反应刚开始时反应速率盐酸等于醋酸,反应开始后,反应速率盐酸小于醋酸,反应结束时,产生氢气盐酸小于醋酸.(填大于、小于或等于)
常温下,体积相同pH相同的盐酸和醋酸,同时加入足量表面积相同的锌粒,反应刚开始时反应速率盐酸等于醋酸,反应开始后,反应速率盐酸小于醋酸,反应结束时,产生氢气盐酸小于醋酸.(填大于、小于或等于)
分析 盐酸是强酸,能够完全电离,醋酸是弱酸,不能够完全电离,存在电离平衡,pH相同的盐酸和醋酸,氢离子浓度相同,醋酸浓度大于盐酸,在醋酸溶液中随氢离子的减少,醋酸的电离平衡正向移动,据此分析.
解答 解:pH相同的盐酸和醋酸,氢离子浓度相同,两种溶液分别与足量的锌反应,反应刚开始时的速率相同,醋酸浓度大于盐酸;在醋酸溶液中随氢离子的减少,醋酸的电离平衡正向移动,醋酸中氢离子浓度大于盐酸,所以整个反应过程的平均速率醋酸快;pH相同的盐酸和醋酸,醋酸浓度大于盐酸,生成氢气的量醋酸多,
故答案为:等于;小于;小于.
点评 本题考查了强弱电解质的相关知识,注意弱电解质在水溶液中不能完全电离,存在电离平衡,题目难度不大.

练习册系列答案
 学习实践园地系列答案
学习实践园地系列答案
相关题目
6.0.5L AlCl3溶液中Cl-为9.03×1022个,则AlCl3溶液的物质的量浓度为( )
| A. | 0.1 mol•L-1 | B. | 1 mol•L-1 | C. | 3 mol•L-1 | D. | 1.5 mol•L-1 |
10.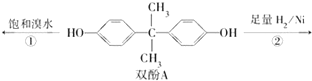 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
 用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )
用双酚A作食品、饮料包装和奶瓶等塑料制品的添加剂,能导致人体内分泌失调,对儿童的健康危害更大.双酚A可发生如下的反应①和②,下列有关双酚A的叙述不正确的是( )| A. | 双酚A的分子式是C15H16O2 | |
| B. | 反应①中,1 mol双酚A最多消耗2 mol Br2 | |
| C. | 双酚A的核磁共振氢谱显示氢原子数之比是1:2:2:3 | |
| D. | 反应②的产物中只有一种官能团 |
20.下列事实不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 反应H2(g)+I2(g)?2HI(g) 达到平衡后,压缩容器的体积,体系颜色加深 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)△H<0,达平衡后,升高温度体系颜色变深 | |
| D. | 增大压强,有利于SO2与O2反应生成SO3 |
4.可以证明烧杯中的硝酸钾溶液是饱和溶液的方法是( )
| A. | 蒸发掉1克水,有少量固体析出 | B. | 降低温度,有少量固体析出 | ||
| C. | 加入少量硝酸钾固体,固体不溶解 | D. | 加入少量水,没有固体析出 |
5.如图所示装置,肯定不符合气密性要求的是( )
| A. | 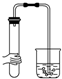 | B. |  | C. | 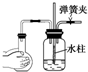 | D. |  |
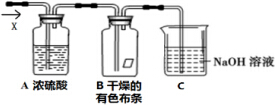 某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:
某同学应用如图所示装置研究物质的性质.其中气体X的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题: