题目内容
17.对下列事实的解释不正确的是( )| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 反应CuSO4+H2S=CuS↓+H2SO4,说明硫化铜既不溶于水,也不溶于稀硫酸 | |
| C. | 常温下浓硫酸、浓硝酸可以用铝罐储存,说明浓硫酸、浓硝酸与铝不反应 | |
| D. | 漂白粉长期放置在空气中会失效,说明其主要成分与空气中的某成分发生了反应 |
分析 A.浓硫酸能将有机物中H、O元素以2:1水的形式脱去而体现脱水性;
B.硫酸是强酸,该反应中生成CuS,则CuS不溶于水和稀硫酸;
C.常温下,Al和浓硫酸、浓硝酸发生钝化现象;
D.漂白粉不稳定,易和空气中水、二氧化碳反应生成碳酸钙而失效.
解答 解:A.浓硫酸能将有机物中H、O元素以2:1水的形式脱去而体现脱水性,该反应中浓硫酸还体现强氧化性,故A正确;
B.硫酸是强酸,该反应中生成CuS,CuS是沉淀,说明CuS不溶于水和稀硫酸,故B正确;
C.常温下,Al和浓硫酸、浓硝酸发生反应生成致密的氧化物薄膜而阻止进一步被氧化,该现象是钝化现象,故C错误;
D.漂白粉不稳定,易和空气中水、二氧化碳反应生成碳酸钙和HClO,HClO不稳定生成氧气和HCl,所以漂白粉放置在空气中易失效,故D正确;
故选C.
点评 本题考查物质之间的转化,侧重考查元素化合物知识,知道浓硫酸的强氧化性、吸水性和脱水性,一般来说,强酸能和弱酸盐反应生成弱酸,但B选项例外,为易错点.

练习册系列答案
 字词句段篇系列答案
字词句段篇系列答案
相关题目
7.亚氯酸钠(NaClO2)是一种性能优良的漂白剂,但在酸性溶液发生分解:5HClO2→4ClO2↑+H++Cl-+2H2O.向亚氯酸钠溶液中加入盐酸,反应剧烈.若将盐酸改为pH相同的稀硫酸,开始反应缓慢,稍后产生气体速度较快,速度变化的原因是( )
| A. | 逸出ClO2使生成物浓度降低 | B. | 酸使HClO2的分解加速 | ||
| C. | 溶液中的H+起催化作用 | D. | 溶液中的Cl-起催化作用 |
5.下列有关实验装置进行的相应实验,能达到实验目的是( )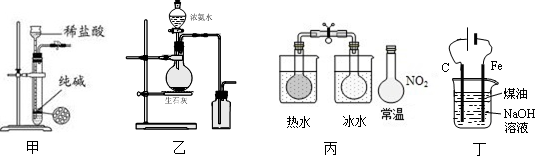

| A. | 用图甲所示装置控制制取少量纯净的CO2气体 | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置可以说明反应2NO2(g)?N2O4(g)是放热反应 | |
| D. | 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
12.下列选项描述的过程能实现化学能转化成热能的是( )
| A. |  光合作用 | B. |  烧炭取暖 | C. |  风力发电 | D. |  电解冶炼 |
2.放射性同位素钬${\;}_{67}^{166}$Ho的原子核内的中子数与核外的电子数之差是( )
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
9.一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的氢气在同样条件下完全燃烧生成液态水,放出热量值为Q2,Q1与Q2的关系为( )
| A. | Q1>Q2 | B. | Q1=Q2 | C. | Q1<Q2 | D. | 无法确定 |
6.下列实验装置图及实验用品均正确的是(部分夹持仪器未画出)( )
| A. | 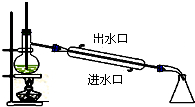 石油的蒸馏 | B. | 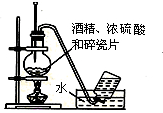 实验室用乙醇制乙烯 | ||
| C. | 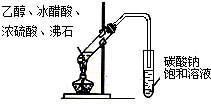 实验室制取乙酸乙酯 | D. | 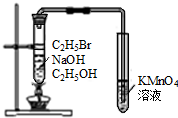 验证溴乙烷发生消去反应 |
7.下列说法正确的是( )
| A. | 某晶体固态不导电,水溶液能导电说明该晶体是离子晶体 | |
| B. | 原子晶体的原子间只存在共价键,而分子晶体内只存在范德华力 | |
| C. | 分子组成相差一个或几个CH2原子团的有机物是同系物 | |
| D. | 在氢原子的基态电子的概率分布图中,小黑点的疏密程度表示电子在该区域空间出现概率的大小 |
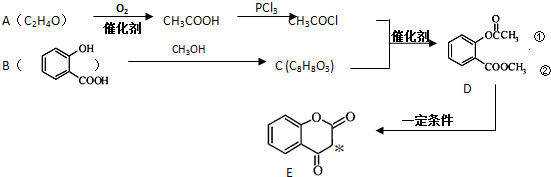
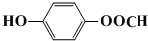 .
.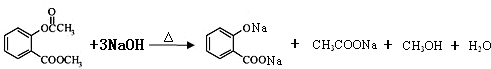 .
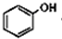
.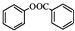 ),根据题目信息设计合成线路,请写出最后一步反应的化学方程式:
),根据题目信息设计合成线路,请写出最后一步反应的化学方程式: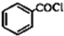 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$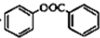 +HCl.
+HCl.