题目内容
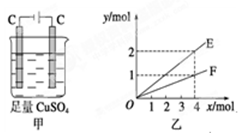
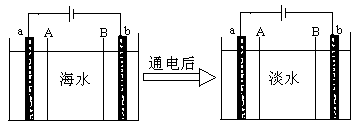
以惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1mol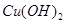 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
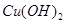 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
D
试题分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和OH-离子均放电。
Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,?即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,由电解的总反应式
2H2O+2CuSO4
 2Cu+O2↑+2H2SO4 转移电子
2Cu+O2↑+2H2SO4 转移电子2mol 4mol
0.1mol 0.2mol
2H2O
 2H2↑+O2↑?转移电子
2H2↑+O2↑?转移电子2mol 4mol
0.1mol 0.2mol
所以电解过程中共转移电子为0.4 mol,答案选D。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量,有利于培养学生的逻辑推理能力和逆向思维能力。

练习册系列答案
相关题目

 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O