题目内容
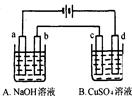
按图装置进行电解(均是惰性电极),已知A烧杯中装有500 mL20%的NaOH溶液,B烧杯中装有500 mL pH为6的1 mol·L-1CuSO4溶液。通电一段时间后,在b电极上收集到28mL气体(标准状况),则B烧杯中溶液pH变为(溶液体积变化忽略不计)

| A.4 | B.3 | C.2 | D.1 |
C
试题分析:根据装置图可知,a电极和电源的负极相连,作阴极,则b电极是阳极,溶液中的OH-放电,电极反应式是4OH--4e-=2H2O+O2↑。氧气的物质的量是0.028L÷22.4L/mol=0.00125mol,转移电子的物质的量是0.00125mol×4=0.005mol。B中总的方程式是2CuSO4+2H2O
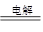 2Cu+2H2SO4+O2↑,则根据电子的得失守恒可知,硫酸铜是过量的。则溶液中氢离子的物质的量是0.005mol,氢离子的浓度是0.005mol÷0.5L=0.01mol/L,所以pH=2,答案选C。
2Cu+2H2SO4+O2↑,则根据电子的得失守恒可知,硫酸铜是过量的。则溶液中氢离子的物质的量是0.005mol,氢离子的浓度是0.005mol÷0.5L=0.01mol/L,所以pH=2,答案选C。点评:该题是高考中的常见题型,试题综合性强,贴近高考。有利于激发学生的学习兴趣,调动学生的学习兴趣。该题的关键是明确电解的工作原理,特别是是电极产物的判断,然后借助于电子的得失守恒列式计算即可,有利于培养学生的逻辑思维能力和规范答题能力。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
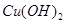 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为: