题目内容
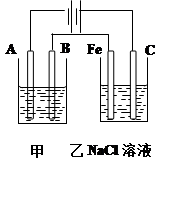
重铬酸钾又名红矾钾,是化学实验室中的一种重要分析试剂。工业上以铬酸钾(K2CrO4)为原料,采用电化学法制备重铬酸钾(K2Cr2O7)。制备装置如下图所示(阳离子交换膜只允许阳离子透过):

制备原理:2CrO42-(黄色)+2H+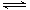 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO42-+4H2O="2" Cr2O72- + 4OH- +2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为 ;此时电路中转移电子的物质的量为 。

制备原理:2CrO42-(黄色)+2H+
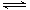 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O(1)通电后阳极室产生的现象为 ,其电极反应式是 。
(2)该制备过程总反应的离子方程式可表示为4CrO42-+4H2O="2" Cr2O72- + 4OH- +2H2↑+O2↑,若实验开始时在右室中加入38.8g K2CrO4,t分钟后测得右室中K与Cr的物质的量之比为3:2,则溶液中K2CrO4和K2Cr2O7的物质的量之比为 ;此时电路中转移电子的物质的量为 。
(每空2分,共8分)
(1)阳极产生无色气体,溶液由黄色逐渐变为橙色;
4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+
(2)2:1 ; 0.1 mol
(1)阳极产生无色气体,溶液由黄色逐渐变为橙色;
4OH--4e-=O2↑+2H2O 或2H2O-4e-=O2↑+4H+
(2)2:1 ; 0.1 mol
试题分析:(1)电解池中阳极失去电子,发生氧化反应。则阳极是溶液中的OH-放电生成氧气,电极反应式是4OH--4e-=O2↑+2H2O。由于OH-被电解,破坏了阳极周围水的电离平衡导致阳极周围溶液显酸性,则促进可逆反应向2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O正反应方向移动,所以阳极周围的实验现象是阳极产生无色气体,溶液由黄色逐渐变为橙色。
Cr2O72-(橙色)+H2O正反应方向移动,所以阳极周围的实验现象是阳极产生无色气体,溶液由黄色逐渐变为橙色。(2)设溶液中K2CrO4和K2Cr2O7的物质的量分别是x和y,则(2x+2y):(x+2y)=3:2,解得x:y=2:1。38.8g K2CrO4的物质的量是38.8g÷194g/mol=0.2mol,所以根据Cr原子守恒可知,生成的K2Cr2O7的物质的量是0.05mol。根据方程式4CrO42-+4H2O=2 Cr2O72- + 4OH- +2H2↑+O2↑,每生成2molK2Cr2O7,反应中转移4mol电子,所以此时电路中转移电子的物质的量为0.05mol×4=0.1mol。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
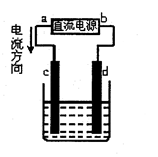
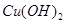 ,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为:
,恰好恢复到电解前的pH和浓度,则电解过程中转移的电子的物质的量为: