题目内容
9.把6mol铜粉投入含8mol硝酸和2mol硫酸的稀溶液中,则标准状况下放出的气体的物质的量为( )| A. | 2 mol | B. | 3 mol | C. | 4 mol | D. | 5 mol |
分析 发生3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,混合溶液中n(H+)=8mol+2mol×2=12mol,n(Cu)=6mol,n(NO3-)=8mol,以量不足的计算生成NO气体的体积,以此来解答.
解答 解:混合溶液中n(H+)=8mol+2mol×2=12mol,n(Cu)=6mol,n(NO3-)=8mol,
由3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O可知,
6molCu反应需要消耗16molH+,4molNO3-,则H+不足,H+完全反应,
设生成NO的物质的量为x,则
3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
8 2
12mol x
$\frac{8}{12mol}=\frac{2}{x}$,解得x=3mol,
故选B.
点评 本题考查氧化还原反应的计算及硝酸盐的性质,为高频考点,把握发生的离子反应及氢离子不足是解答本题的关键,学生容易直接利用硝酸的物质的量计算而出错,题目难度不大.

练习册系列答案
相关题目
19.下列对硝酸的认识,不正确的是( )
| A. | 浓硝酸和稀硝酸都具有氧化性 | B. | 铜与硝酸的反应属于置换反应 | ||
| C. | 金属与硝酸反应不产生氢气 | D. | 可用铁或铝制品盛装浓硝酸 |
20.下列叙述,说法合理的是( )
| A. | 任何物质燃烧都必须有氧气参加 | |
| B. | 氢气在氯气中燃烧发出淡蓝色火焰,并在空气中产生大量白雾 | |
| C. | 饱和氯水在光照下有气泡产生,该气体为氯气 | |
| D. | 长久放置的氯水将失去漂白性 |
17.下列物质或微粒中,按只有还原性,只有氧化性,既有氧化性又有还原性的顺序排列的一组是( )
| A. | Na、Cl2、Br2 | B. | H2、N2O4、Cl2 | C. | I-、F2、H2O | D. | SO2、H+、HCl |
14.室温下,在0.01mol•L-1NaOH某溶液中,由水电离的[OH-]为( )
| A. | 1.0×10-7mol•L-1 | B. | 1.0×10-6mol•L-1 | ||
| C. | 1.0×10-2mol•L-1 | D. | 1.0×10-12mol•L-1 |
1.下列叙述正确的是( )
| A. | 任何晶体中,若含有阳离子也一定含有阴离子 | |
| B. | 原子晶体中只含有共价键 | |
| C. | 离子晶体中只含有离子键 | |
| D. | 分子晶体中只存在分子间作用力,不含化学键 |
18.下列各类材料一定属于新型材料的是( )
| A. | 塑料 | B. | 纤维 | C. | 橡胶 | D. | 生物材料 |
19.某化学探究小组设计如图所示(部分夹持装置已略去)实验装置,以探究潮湿的Cl2与Na2CO3反应得到的固体物质的成分.具体操作如下:向C装置中通入一定量的氯气后,测得只生成一种气体Cl2O.可以确定的是C得到的固体中最多含有三种物质,含有氯元素的盐只有一种,且一定含有NaHCO3.现对C中得到的固体进行猜想和验证.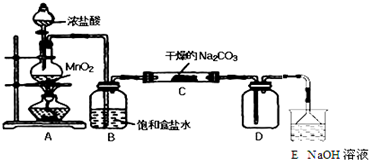
①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸

①提出合理猜想:C中一定含有NaHCO3和NaCl;可能含有剩余的Na2CO3.
②设计方案,进行成分检验.请你参与并完成实验步骤3、4以及预期现象和结论,将答案填入下表的相应空格内.限选实验试剂:蒸馏水、稀HNO3、BaCl2溶液、澄清石灰水、AgNO3溶液、品红、稀盐酸
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
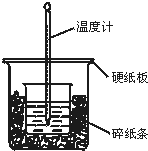 50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液在图示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: