题目内容
(15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题: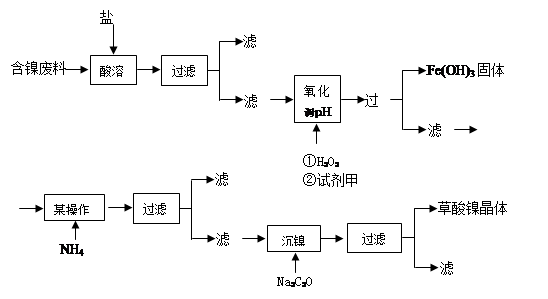
(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6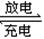 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
(15分)(1)减少过氧化氢的分解(1分) Cu+ H2O2+2H+= Cu2++ 2H2O(2分)
(2)3.3(2分)
(3)除去Ca2+、Mg2+(2分)
(4)4(NiC2O4·2H2O)+3O2 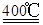 2Ni2O3+8CO2+8H2O(2分)
2Ni2O3+8CO2+8H2O(2分)
(5)Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O(2分) 1.25a mol(2分)
(6)LaNi5H6+6OH--6e-=LaNi5+6 H2O(2分)
解析试题分析:(1)过氧化氢受热易分解,所以温度不能过高的原因是减少过氧化氢的分解;Fe、Ca、Mg均与盐酸直接反应,过氧化氢的加入造成酸溶过滤后的滤液中增加一种金属离子,则该金属离子只能是铜离子,所以反应的离子方程式为Cu+ H2O2+2H+= Cu2++ 2H2O;
(2)Ksp[(Fe(OH))3]=4.0×10-38=c(Fe3+)c(OH-)3,c(OH-)3=8×10-33mol/L,c(OH-)=2×10-11mol/L,所以c(H+)=5×10-4,lg5=0.7,所以pH=3.3;
(3)加入NH4F后的操作是过滤,说明该过程有沉淀产生,所以加入NH4F的目的是除去Ca2+、Mg2+;
(4)根据题目可知无毒气体是二氧化碳,
所以化学方程式为4(NiC2O4·2H2O)+3O2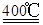 2Ni2O3+8CO2+8H2O;
2Ni2O3+8CO2+8H2O;
(5)根据氧化还原反应理论,Cl2氧化Ni(OH)2生成三氧化二镍,自身被还原为氯离子,化学方程式为Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O;amol二价镍全部转化为三价镍时,需要氯气0.5amol,氯气的利用率是80%,则电解过程中的氯气是0.5amol/0.8,每生成1mol氯气转移2mol电子,所以外电路中通过电子的物质的量是0.5amol/0.8×2=1.25amol;
(6)NiO(OH)中Ni的化合价是+3价,Ni(OH)2中Ni是+2价,化合价降低,发生还原反应,所以放电时负极应发生氧化反应,LaNi5H6为负极反应物质,LaNi5H6中各元素化合价均可看作是零,所以化合价升高的只能是H元素,电极反应式为LaNi5H6+6OH--6e-=LaNi5+6 H2O。
考点:考查溶度积的计算,流程的分析,化学方程式的判断与书写,氧化还原反应的计算,电化学理论的应用

 一线名师提优试卷系列答案
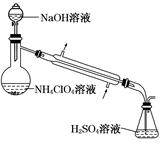
一线名师提优试卷系列答案某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,工艺流程如下: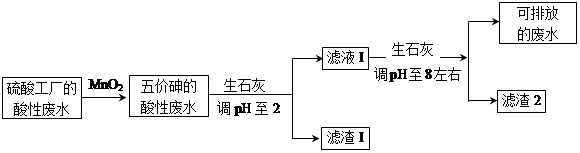
相关数据如下表,请回答以下问题:
表1.几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
表2.工厂污染物排放浓度及允许排放标准
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4g/L | 1.6g·L-1 |
| 排放标准 | pH 6~9 | 0.5mg·L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)= mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4mol·L-1,c(AsO43-)= mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为 ;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀,原因为
。
③砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3 K2=1.7×10-7 K3=4.0×10-12,第三步电离的平衡常数的表达式为K3= 。Na3AsO4的第一步水解的离子方程式为:AsO43-+H2O
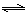 HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。
HAsO42-+OH-,该步水解的平衡常数(25℃)为: (保留两位有效数字)。  L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性; a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
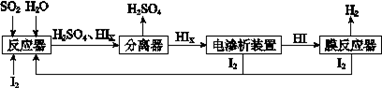
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)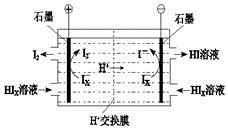 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: