题目内容
(15分)氮元素的化合物在工农业以及国防科技中用途广泛,但也会对环境造成污染,如地下水中硝酸盐造成的氮污染已成为一个世界性的环境问题。请回答下列问题:
(1)某课题组模拟地下水脱氮过程,利用Fe粉和KNO3溶液反应探究脱氨原理。
①用适量0.1mol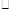 L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
L-1H2SO4洗涤Fe粉,主要反应的化学方程式为 ,之后用蒸馏水洗涤铁粉至中性;
②将KNO3溶液的pH调至2.5;
③向②调节pH后的KNO3溶液中持续通入一段时间N2,目的是 。
④用足量Fe粉还原③处理后的KNO3溶液。充分反应后,取少量反应液,加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,请根据以上信息写出Fe粉和KNO3溶液反应的离子方程式__。
(2)神舟载人飞船的火箭推进器中常用肼(N2H4)作燃料。NH3与NaClO反应可得到肼(N2H4),该反应中氧化剂与还原剂的物质的量之比为 。
(3)常温下向含0.01 mol HCl的溶液中缓缓通入224 mLNH3(标准状况,溶液体积变化忽略不计)。
①在通入NH3的过程中,溶液的导电能力 _________ (填“增强”、“减弱”或“基本不变”),理由是 ;水的电离程度 (填“增大”、“减小”或“基本不变”)。
②向HCl和NH3完全反应后的溶液中继续通入NH3,所得溶液中的离子浓度大小关系可能正确的是 (填字母编号)。
a.c(H+)>c(C1-)>c(OH-)>c(NH4+) b.c(NH4+)>c(C1-)>c(H+)>c(OH-)
c.c(NH4+)>c(H+)>c(C1-)>c(OH-) d.c(C1)=c(NH4+)>c(H+)=c(OH-)
(1)①Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ②防止空气中的O2干扰反应
④4Fe+NO3-+10H+=4Fe2++NH4++3H2O (2)1:2
(3)①基本不变 溶液中的离子总浓度基本不变 增大 ②d
解析试题分析:(1)①铁表面的氧化物主要是氧化铁,因此H2SO4可以除去Fe粉表面的氧化物是发生反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
②氧气具有氧化性,而空气中含有大量的氧气,所以为防止空气中的O2对脱氮的影响,可向KNO3溶液中通入N2,排出O2;
④加入足量NaOH溶液,加热,产生能使湿润红色石蕊试纸变蓝的气体,该气体是氨气,说明溶液中含有铵盐,即硝酸根的还原产物是铵根,因此Fe粉和KNO3溶液反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O;
(2)NH3与NaClO反应可得到肼(N2H4),反应中氮元素的化合价从-3价升高到-2价,失去1个电子,而次氯酸钠中氯元素的化合价从+1价降低到-1价,得到2个电子,因此根据电子得失守恒可知该反应中氧化剂与还原剂的物质的量之比为1:2;
(3)①氨气与盐酸反应生成氯化铵,由于氯离子浓度基本不变,因此在通入NH3的过程中,溶液的导电能力基本不变;由于氯化铵水解,因此水的电离程度增大;
②a.HCl和NH3完全反应后生成氯化铵,向溶液中继续通入NH3,氨气溶于水生成一水合氨,一水合氨是弱电解质,部分电离,因此溶液中c(NH4+)>c(OH-),a不正确;b.根据电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-)可知c(NH4+)>c(C1-)>c(H+)>c(OH-)不可能存在,b不正确;c.根据电荷守恒c(NH4+)+c(H+)=c(C1-)+c(OH-)可知c(NH4+)>c(H+)>c(C1-)>c(OH-)不可能存在,c不正确;d.溶液可能显中性,因此c(C1)=c(NH4+)>c(H+)=c(OH-)可以存在,d正确,答案选d。
考点:考查实验条件控制、方程式书写、氧化还原反应计算、水的电离、盐类水解以及溶液中离子浓度大小比较等

草酸(H2C2O4)是二元弱酸,25℃时,H2C2O4:K1=5.4×10-2,K2=5.4×10-5;H2CO3:K1=4.5×10-7,K2=4.7×10-11。
(1)KHC2O4溶液呈__________性(填“酸”、“中”或“碱”)。
(2)下列化学方程式可能正确的是 。
A.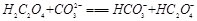 |
B.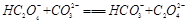 |
C.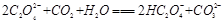 |
D.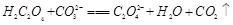 |
①当V<10时,反应的离子方程式为______________________________________________。
②若溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+c(HC2O4-),则pH______7(填“>”“<”或“=”),V________10(填“>”“<”或“=”)。
③当溶液中离子浓度有如下关系:c(K+)=c(C2O42-)+c(HC2O4-)+c(H2C2O4),则溶液中溶质为____________,V________10(填“>”、“<”或“=”)。
④当V=20时,溶液中HC2O4-、C2O42-、H2C2O4、OH-的物质的量浓度从大到小的顺序为____________________________________________________________________________________。
碱式碳酸铜是一种用途广泛的化工原料。工业上可用酸性刻蚀废液(主要成分有Cu2+、Fe2+、Fe3+、H +、Cl-)制备,其制备过程如下: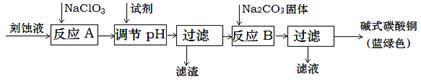
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
(1)氯酸钠的作用是 ;滤渣的主要成分是 (写化学式)。
(2)调节反应A后溶液的pH范围应为 。可以选择的试剂是 (填序号)。
a.氨水 b.稀硫酸 c.氢氧化钠 d.碳酸铜
(3)反应B的温度如过高,则所得蓝绿色产品中可能会出现的杂质是 。(写化学式)
(4)过滤得到的产品洗涤时,如何判断产品已经洗净? 。
(5)将Na2CO3溶液滴入到一定量CuCl2溶液中得到沉淀。
① 若沉淀只有CuCO3,则相应的离子方程式为 。
② 若沉淀只有Cu(OH)2,用相应的离子方程式表示其过程 。
③ 若生成Cu(OH)2和CuCO3的混合物(即碱式盐)。则说明 。
(6)碱式碳酸铜组成可表示为:aCuCO3?bCu(OH)2?cH2O,现通过下列方案测定其组成。步骤如下:
① 称量样品;② 高温分解;③ 测出CO2的质量;④ 测出水蒸汽的质量;⑤ 称量CuO。
请对上述测定方案作出评价。 。
在80℃时,将0.8mol的A气体充入4L已抽空的固定容积的密闭容器中发生反应:A(g)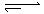 mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
mB(g)隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) c(mol/L) | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A) | 0.20 | 0.14 | b | 0.09 | 0.09 | 0.09 |
| c(B) | 0.00 | 0.12 | 0.20 | c | d | e |
(2)100秒后若将容器的体积缩小至原来一半,平衡时A的浓度____________0.09 mol/L(填“<”、“=”或“>”)。
(3)在80℃时该反应的平衡常数K值为 (保留1位小数)。
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 。
①A的转化率越高 ②A与B的浓度之比越大
③B的产量越大 ④正反应进行的程度越大
A、B、C、D四种物质溶于水均完全电离,电离出的离子如下表。
| 阳离子 | Na+、Al3+、Ba2+、H+、NH4+ |
| 阴离子 | SO42-、OH-、CO32-、Cl- |
现进行如下实验:
①足量A溶液与B溶液混合共热可生成沉淀甲和刺激性气味气体;
②少量A溶液与C溶液混合可生成沉淀乙;
③A溶液与B溶液均可溶解沉淀乙,但都不能溶解沉淀甲。
请回答:
(1)A的化学式为_________;室温时,将pH相等的A溶液与D溶液分别稀释10倍,pH分别变为a和b,则a _______b(填“>”、“=”或“<”)。
(2)加热蒸干C溶液并灼烧,最后所得固体为_______ (填化学式)。
(3)C溶液与D溶液反应的离子方程式为_______
(4)向B溶液中逐滴加入等体积、等物质的量浓度的NaOH溶液,滴加过程中水的电离平衡将_______ (填“正向”、“不”或“逆向”)移动;最终所得溶液中各离子浓度由大到小的顺序为____________________
(5)已知沉淀甲的Ksp=x。将0.03mol·L-1的A溶液与0.01mol·L-1的B溶液等体积混合,混合溶液中酸根离子的浓度为_______ (用含x的代数式表示,混合后溶液体积变化忽略不计)。
某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液。
其操作可分解为如下几步:
a. 移取20.00mL待测的NaOH溶液注入洁净的锥形瓶,并加入2-3滴酚酞
b. 用标准盐酸溶液润洗滴定管2-3次
c. 把盛有标准溶液的酸式滴定管固定好,调节液面使滴定管尖嘴充满溶液
d. 取标准盐酸溶液注入酸式滴定管至0刻度以上2-3cm
e. 调节液面至0或0刻度以下,记下读数
f. 把锥形瓶放在滴定管的下面,用标准盐酸溶液滴定至终点,记下滴定管液面的刻度
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)__________________ ____。
(2)滴定终点时溶液的颜色变化是 。
(3)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_____ ___。
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
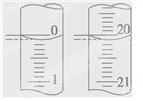
(5)某学生根据3次实验分别记录有关数据如下表:
| 滴定 次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.20 | 20.22 | |
| 第二次 | 25.00 | 0.56 | 24.54 | |
| 第三次 | 25.00 | 0.42 | 20.40 | |
依据上表数据求得NaOH溶液的物质的量浓度为 。
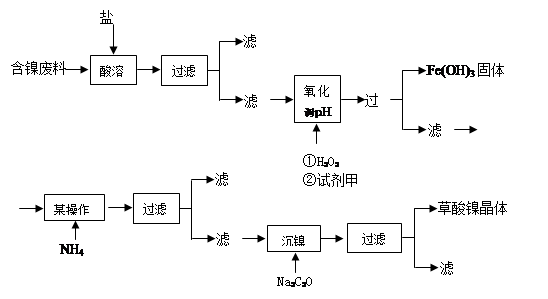
 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。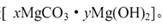
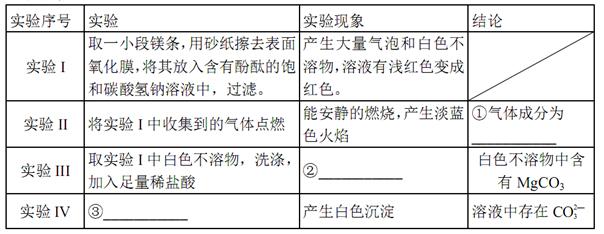
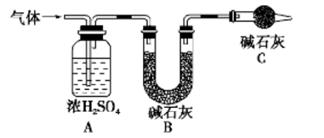
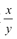 的值___(填“偏大”、“偏小”或“不变”
的值___(填“偏大”、“偏小”或“不变”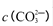
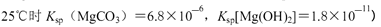


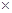 10-20,该温度下反应:Cu2++2H2O
10-20,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。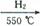 FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。
FexNy+H2 (未配平),若整个过程中消耗氨气34.0g,消耗赤铁矿石2kg,设整个过程中无损耗,则FexNy磁粉的化学式为 。