题目内容
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| B、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
| C、22.4L的CO2气体与1mol N2O所含的电子数均为22NA |
| D、T℃时,1L pH=6的纯水中,含OH-的数目为10-6NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成的二氧化硫小于0.46mol;
B.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算气体的物质的量;
D.纯水中氢离子与氢氧根离子的物质的量相等,据此计算出水中含有的氢氧根离子数目.
B.氯气溶于水,只有部分氯气与水反应生成氯化氢和次氯酸;
C.没有告诉在标准状况下,不能使用标况下的气体摩尔体积计算气体的物质的量;
D.纯水中氢离子与氢氧根离子的物质的量相等,据此计算出水中含有的氢氧根离子数目.
解答:
解:A.50mL 18.4mol/L浓硫酸中含有0.92mol硫酸,消耗0.92mol硫酸会生成0.46mol二氧化硫,由于铜与稀硫酸不反应,随着反应的进行,浓硫酸变成稀硫酸,反应停止,所以反应生成的二氧化硫小于0.46mol,生成SO2分子数目小于0.46NA,故A错误;
B.0.1mol氯气溶于水,只有少量的氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于0.1mol,转移的电子数目小于0.1NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量,故C错误;
D.pH=6的纯水中,氢离子浓度为10-6mol/L,纯水中氢离子与氢氧根离子浓度相等,则1L纯水中氢氧根离子的物质的量为10-6mol,含OH-的数目为10-6NA,故D正确;
故选D.
B.0.1mol氯气溶于水,只有少量的氯气与水反应生成氯化氢和次氯酸,反应转移的电子小于0.1mol,转移的电子数目小于0.1NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算二氧化碳的物质的量,故C错误;
D.pH=6的纯水中,氢离子浓度为10-6mol/L,纯水中氢离子与氢氧根离子浓度相等,则1L纯水中氢氧根离子的物质的量为10-6mol,含OH-的数目为10-6NA,故D正确;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项A为易错点,注意稀硫酸不与铜发生反应.

练习册系列答案
相关题目
下列反应的离子方程式正确的是( )
| A、氯气与烧碱溶液反应:Cl2+H2O═Cl-+ClO-+2H+ |
| B、向氯化亚铁溶液中滴入氯水:2Fe2++Cl2═2Fe3++2Cl- |
| C、AlCl3溶液中加入过量的烧碱溶液:Al3++3OH-═Al(OH)3↓ |
| D、小苏打溶液中加入过量的澄清石灰水:Ca2++OH-+HCO3-═CaCO3↓+H2O |
下列各种溶液中通入足量的SO2后,既无沉淀又无气体产生的有( )种
①Ba(OH)2 ②Ba(NO3)2 ③Na2S ④BaCl2 ⑤Ca(ClO)2 ⑥Fe(NO3)3⑦H2O2 ⑧NaClO ⑨C6H5ONa.
①Ba(OH)2 ②Ba(NO3)2 ③Na2S ④BaCl2 ⑤Ca(ClO)2 ⑥Fe(NO3)3⑦H2O2 ⑧NaClO ⑨C6H5ONa.
| A、3 | B、4 | C、5 | D、6 |
下列事实中,能说明HNO2是弱电解质的是( )
| A、用HNO2溶液做导电性实验,灯泡较暗 |
| B、HNO2是共价化合物 |
| C、HNO2溶液不与NaCl反应 |
| D、室温下,0.1mol?L-1 HNO2溶液的pH为2.15 |
下列说法正确的是( )
| A、糖类、油脂、蛋白质都能够发生水解反应 |
| B、酯在碱性条件下的水解反应叫皂化反应 |
| C、煤的干馏、石油的分馏都是化学变化 |
| D、在船身装上锌块利用的是牺牲阳极的阴极保护法 |
设NA为阿伏加德罗常数,下列说法不正确的是( )
①在铝热反应中,用滤纸做的漏斗必须干燥
②常温常压下,1mol氯气与足量的金属铁反应,转移2NA个电子
③标准状况下,含NA个氧原子的氧单质的体积一定为11.2L
④铅蓄电池中每消耗1mol 硫酸,电路中转移电子数为2NA
⑤将NO2和N2O4分子共NA个降温至标况下,其体积为22.4L
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸酸性比碳酸强
⑦化学变化不产生新元素,产生新元素的变化不是化学变化.
①在铝热反应中,用滤纸做的漏斗必须干燥
②常温常压下,1mol氯气与足量的金属铁反应,转移2NA个电子
③标准状况下,含NA个氧原子的氧单质的体积一定为11.2L
④铅蓄电池中每消耗1mol 硫酸,电路中转移电子数为2NA
⑤将NO2和N2O4分子共NA个降温至标况下,其体积为22.4L
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸酸性比碳酸强
⑦化学变化不产生新元素,产生新元素的变化不是化学变化.
| A、①②⑥ | B、①③④⑤⑥ |
| C、③④⑤⑥ | D、②⑤⑥⑦ |
下列叙述正确的是( )
| A、金属氧化物只可能是碱性氧化物或者两性氧化物 |
| B、鸡蛋清中加入硫酸铜溶液会发生盐析现象 |
| C、蔗糖、淀粉、油脂及其水解产物均为非电解质 |
| D、有机分子的结构简式和实验式可能是相同的 |
能将化学能转化为电能的装置(溶液均为稀硫酸)是( )
A、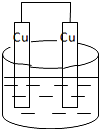 |
B、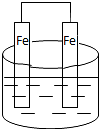 |
C、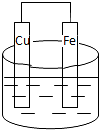 |
D、 |