题目内容
设NA为阿伏加德罗常数,下列说法不正确的是( )
①在铝热反应中,用滤纸做的漏斗必须干燥
②常温常压下,1mol氯气与足量的金属铁反应,转移2NA个电子
③标准状况下,含NA个氧原子的氧单质的体积一定为11.2L
④铅蓄电池中每消耗1mol 硫酸,电路中转移电子数为2NA
⑤将NO2和N2O4分子共NA个降温至标况下,其体积为22.4L
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸酸性比碳酸强
⑦化学变化不产生新元素,产生新元素的变化不是化学变化.
①在铝热反应中,用滤纸做的漏斗必须干燥
②常温常压下,1mol氯气与足量的金属铁反应,转移2NA个电子
③标准状况下,含NA个氧原子的氧单质的体积一定为11.2L
④铅蓄电池中每消耗1mol 硫酸,电路中转移电子数为2NA
⑤将NO2和N2O4分子共NA个降温至标况下,其体积为22.4L
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸酸性比碳酸强
⑦化学变化不产生新元素,产生新元素的变化不是化学变化.
| A、①②⑥ | B、①③④⑤⑥ |
| C、③④⑤⑥ | D、②⑤⑥⑦ |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:①在铝热反应中会放出大量的热,所以滤纸必须湿润,避免漏斗被破坏;
②常温常压下,1mol氯气与足量的金属铁反应,转移2mol电子;
③含NA个氧原子的物质的量为1mol,氧气单质分为臭氧和氧气,二者含有的原子数不同,需要的物质的量不同;
④铅蓄电池的总反应为:Pb+PbO2+2H2SO4
2H2O+2PbSO4,每消耗1mol硫酸,电路中转移电子数为1mol;
⑤二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动,总物质的量小于1mol;
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸钙的稳定性大于碳酸钙,不能说明硅酸酸性比碳酸强;
⑦化学变化的最小微粒为原子,反应中原子的种类一定不能发生变化,否则不属于化学变化.
②常温常压下,1mol氯气与足量的金属铁反应,转移2mol电子;
③含NA个氧原子的物质的量为1mol,氧气单质分为臭氧和氧气,二者含有的原子数不同,需要的物质的量不同;
④铅蓄电池的总反应为:Pb+PbO2+2H2SO4
| 放电 |
| 充电 |
⑤二氧化氮与四氧化二氮之间存在转化平衡:2NO2(g)?N2O4(g),该反应为放热反应,将NO2和N2O4分子共NA个降温至标况下,平衡向着正向移动,总物质的量小于1mol;
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,说明硅酸钙的稳定性大于碳酸钙,不能说明硅酸酸性比碳酸强;
⑦化学变化的最小微粒为原子,反应中原子的种类一定不能发生变化,否则不属于化学变化.
解答:
解:①在铝热反应中会放出大量的热量,所以用滤纸做的漏斗必须湿润,避免漏斗被破坏,故①错误;
②常温常压下,1mol氯气与足量的金属铁反应得到2mol电子,根据电子守恒,转移了2mol电子,转移了2NA个电子,故②正确;
③标准状况下,含NA个氧原子的物质的量为1mol,而氧单质分为臭氧和氧气,氧气中含有2个氧原子,臭氧中含有3个氧原子,没有明确氧单质名称,无法计算气体的体积,故③错误;
④铅蓄电池的反应方程式为:Pb+PbO2+2H2SO4
2H2O+2PbSO4,每消耗1mol硫酸,电路中转移1mol电子,转移的电子数为NA,故④错误;
⑤将NO2和N2O4分子共NA个降温至标况下,可逆反应2NO2(g)?N2O4(g)向着正向移动,气体的总物质的量小于1mol,其体积小于22.4L,故⑤错误;
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,只能说明碳酸钙不如硅酸钙稳定,不能说明硅酸酸性比碳酸强,故⑥错误;
⑦化学变化中原子的种类不变,所以不会产生新元素,产生新元素的变化则不属于化学变化,故⑦正确;
故选B.
②常温常压下,1mol氯气与足量的金属铁反应得到2mol电子,根据电子守恒,转移了2mol电子,转移了2NA个电子,故②正确;
③标准状况下,含NA个氧原子的物质的量为1mol,而氧单质分为臭氧和氧气,氧气中含有2个氧原子,臭氧中含有3个氧原子,没有明确氧单质名称,无法计算气体的体积,故③错误;
④铅蓄电池的反应方程式为:Pb+PbO2+2H2SO4
| 放电 |
| 充电 |
⑤将NO2和N2O4分子共NA个降温至标况下,可逆反应2NO2(g)?N2O4(g)向着正向移动,气体的总物质的量小于1mol,其体积小于22.4L,故⑤错误;
⑥二氧化硅与碳酸钙高温下反应生成二氧化碳,只能说明碳酸钙不如硅酸钙稳定,不能说明硅酸酸性比碳酸强,故⑥错误;
⑦化学变化中原子的种类不变,所以不会产生新元素,产生新元素的变化则不属于化学变化,故⑦正确;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
下列关于NaHCO3和Na2CO3的说法正确的是( )
①NaHCO3比Na2CO3稳定,便于长期保存; ②NaHCO3与酸的反应比Na2CO3快;
③鉴别NaHCO3与Na2CO3可以用Ca(OH)2 ④产生等质量的CO2,NaHCO3耗酸少.
①NaHCO3比Na2CO3稳定,便于长期保存; ②NaHCO3与酸的反应比Na2CO3快;
③鉴别NaHCO3与Na2CO3可以用Ca(OH)2 ④产生等质量的CO2,NaHCO3耗酸少.
| A、①③④ | B、①②③④ |
| C、①③ | D、②④ |
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A、50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| B、标准状况下,0.1mol Cl2溶于水,转移的电子数目为0.1NA |
| C、22.4L的CO2气体与1mol N2O所含的电子数均为22NA |
| D、T℃时,1L pH=6的纯水中,含OH-的数目为10-6NA |
 根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )
根据量子力学计算,氮化碳结构有五种,其中一种氮化碳硬度超过金刚石晶体,成为首届一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示.下列有关氮化碳的说法正确的是( )| A、氮化碳属于分子晶体 |
| B、氮化碳的分了式为C3N4 |
| C、该晶体中的碳、氮原子核外都满足8电子稳定结构 |
| D、每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连 |
下列说法正确的是( )
| A、麦芽糖的水解产物能发生银镜反应 |
| B、四氟乙烯(CF2=CF2)中所有的原子都在同一个平面上 |
C、 在酸性条件下水解产物是 在酸性条件下水解产物是 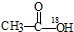 和CH3CH2OH 和CH3CH2OH |
| D、淀粉溶液加适量浓硫酸加热一会儿后,滴入银氨溶液无银镜生成,说明淀粉未水解 |
下列各组离子,在强酸性溶液中可以大量共存的是( )
| A、Na+、Ba2+、Cl-、SO32- |
| B、Na+、Ba2+、AlO2-、NO3- |
| C、NH4+、K+、Cl-、NO3- |
| D、Na+、K+、NO3-、SiO32- |
某醇在适当条件下与足量的乙酸发生酯化,得到的酯的相对分子质量a与原来醇的相对分子量b的关系是a=b+84,有关该醇应该具有的结构特点的描述正确的是( )
| A、该醇分子中一定具有甲基 |
| B、该醇分子中一定没有甲基 |
| C、该醇分子中至少含有三个碳原子 |
| D、该醇分子中具有两个醇羟基 |
香柠檬油可用于化妆品.香柠檬油含微量的香柠檬酚和香柠檬醚,其结构如图.下列说法正确的是( )
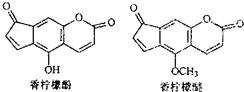

| A、香柠檬醚的分子式为C13H6O4 |
| B、1mol香柠檬酚最多可与2mol Br2发生反应 |
| C、香柠檬酚通过取代反应可转化成香柠檬醚 |
| D、1mol香柠檬酚在NaOH溶液中,最多能消耗2mol NaOH |