题目内容
【题目】溴化亚铁是聚合反应中常用的一种催化剂,易潮解变质,800℃以上可升华,高温时FeBr3会快速分解为FeBr2。某化学小组同学用下图所示装置制备溴化亚铁,请回答相关问题:
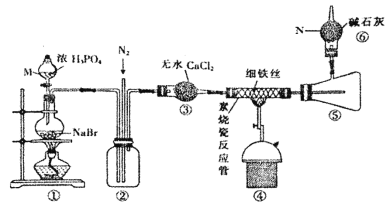
(1)仪器M、N的名称依次是________、________。
(2)装置⑥的作用是____________,从装置末端排出的气体是否需要处理________(填“是”或“否”)
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通N2的目的是__________。
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都具备某种性质,该性质是________。
②溶液变橙黄色是因为发生了副反应___________(写化学方程式)。
③浓磷酸换成浓硫酸对产品纯度_____ (填“有”或“没有”)影响,理由是__________。
【答案】分液漏斗 干燥管 吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤ 是 使装置中残留的HBr被充分吸收,避免造成污染 难挥发性(或高沸点) 2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2
SO2↑+Br2↑+2H2O+Na2SO4 没有 SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2
【解析】
根据装置图可知,装置①用来制备溴化氢,由于溴化亚铁易潮解变质,实验前需要通入氮气排除装置内的空气,装置②可以起到安全瓶的作用,防止装置④中导管出现堵塞,装置③为干燥生成的溴化氢,溴化氢与铁在装置④中反应生成FeBr2,800℃以上溴化亚铁可升华,装置⑤为收集生成的溴化亚铁,装置⑥可以吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤。据此分析解答。
(1)根据常见仪器的结构,仪器M为分液漏斗、N为球形干燥管,故答案为:分液漏斗;球形干燥管;
(2)根据上述分析,装置⑥可以吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤使溴化亚铁潮解变质;铁与溴化氢反应生成溴化亚铁,同时生成了氢气,从装置末端排出的气体中含有氢气,需要处理,否则可能发生爆炸危险,故答案为:吸收未反应的HBr,并防止空气中的水蒸气进入装置⑤;是;
(3)实验结束时要关闭热源并继续通入N2一段时间,此时通入N2可以使装置中残留的HBr被充分吸收,避免造成污染,故答案为:使装置中残留的HBr被充分吸收,避免造成污染;
(4)将浓磷酸换成浓硫酸同样能制得HBr,但反应过程中圆底烧瓶内的溶液变为橙黄色。
①浓磷酸和浓硫酸均能用于制HBr的原因是硫酸和磷酸都是难挥发性酸,故答案为:难挥发性(或高沸点);
②浓硫酸具有强氧化性,能够氧化溴离子生成溴单质,因此溶液变橙黄色是因为发生了副反应2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓)
SO2↑+Br2↑+2H2O+Na2SO4,故答案为:2NaBr+2H2SO4(浓) ![]() SO2↑+Br2↑+2H2O+Na2SO4;
SO2↑+Br2↑+2H2O+Na2SO4;
③用浓硫酸作反应物时,进入素瓷烧反应管的HBr中含有溴蒸气和二氧化硫,二氧化硫与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2,不会影响产品纯度,故答案为:没有;SO2与铁不反应,溴与铁生成的FeBr3在高温下迅速分解为FeBr2。

 阅读快车系列答案
阅读快车系列答案