题目内容
【题目】用下面的方案检验试液中的![]() ,其中方案设计严密的是( )
,其中方案设计严密的是( )
A. 试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B. 试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
C. 试液![]() 白色沉淀
白色沉淀![]() 白色沉淀
白色沉淀
D.试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
【答案】B
【解析】
A.先加HNO3,由于HNO3有强氧化性,若原溶液中有SO32-,会被HNO3氧化为SO42-,遇见Ba2+后会生成BaSO4沉淀,故此方法不能排除SO32-的干扰,A错误;
B.先加HCl,无沉淀,可以排除Ag+的干扰,再加BaCl2,可以排除SO32-、CO32-等离子的干扰,故生成的白色沉淀只能是BaSO4,B正确;
C.先加BaCl2生成白色沉淀,该沉淀可能是AgCl,即不能排除Ag+的干扰,C错误;
D.先加BaCl2无沉淀,故不可能有SO42-,D错误;
故选B。

 习题精选系列答案
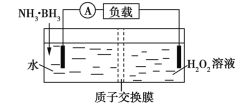
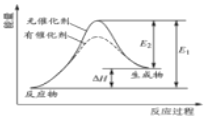
习题精选系列答案【题目】(1)氨气还原氮氧化物的反应为:
①N2(g)+O2(g)=2NO(g) △H1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H2
则4NH3(g)+6NO(g)=5N2(g)+6H2O(1) △H=___。(用含△H1、△H2的式子表示)
依据反应②,将氨气设计成燃料电池,用KOH溶液作电解质溶液,写出负极电极反应式:____。
(2)一定温度下,向2L恒容密闭容器中充4.0molNO2和4.0mol CO,在催化剂作用下发生反应4CO(g)+2NO2(g)N2(g)+4CO2(g) △H<0,测得相关数据如表:
0min | 5min | 10min | 15min | 20min | |
c(NO2)/molL1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/molL1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①05min,用NO2的浓度变化表示的反应速率为______。
②以下表述能说明该反应己达到平衡状态的是_____。
A.2v(NO2)正=v(N2)逆 B.气体密度不再变化
C.气体平均相对分子质量不再变化 D.N2与CO2的物质的量之比保持不变
③20min时,保持温度不变,继续向该容器中加入1.0molNO2和1.0molCO,反应再次达到平衡时,NO2的转化率比原平衡___(填“增大”、“减小”或“不变)。
④该温度下反应的化学平衡常数K=____。
(3)湿法脱硝:采用NaClO2溶液作为吸收剂可对烟气进行脱硝。323K下,向足量碱性NaClO2溶液中通入含NO的烟气,充分反应后,溶液中离子浓度的分析结果如表:
离子 | NO3 | NO2 | Cl |
c/(molL1) | 2.0×104 | 1.0×104 | 1.75×104 |
①NaClO2溶液显碱性,用离子方程式解释原因_____。
②依据表中数据,写出NaClO2溶液脱硝过程中发生总反应的离子方程式_____