题目内容
【题目】铝热法是铝与某些金属氧化物反应获得高熔点金属单质的方法。工业上可用于制造无碳或低碳铁合金。铝粉和赤铁矿发生铝热反应的化学方程式为:Fe2O3+2Al![]() 2Fe+Al2O3。
2Fe+Al2O3。
(1)上述反应中,作为氧化剂的物质是__,化合价升高的元素是__。
(2)若反应中消耗了0.2molAl,生成Fe的物质的量为__mol,转移电子的物质的量为__mol。
【答案】Fe2O3(氧化铁) Al(铝) 0.2 0.6
【解析】
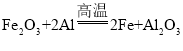 ,该反应中铁的化合价降低,铝的化合价升高,反应转移6个电子。
,该反应中铁的化合价降低,铝的化合价升高,反应转移6个电子。
(1)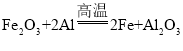 ,该反应中铁从+3价降为0价,故氧化铁做氧化剂,铝从0价升高到+3价,故答案为:
,该反应中铁从+3价降为0价,故氧化铁做氧化剂,铝从0价升高到+3价,故答案为:![]() (氧化铁);Al(铝);
(氧化铁);Al(铝);
(2)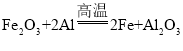 ,反应中铝和铁系数比为1:1,故消耗了0.2molAl的同时会生成0.2mol铁,一个铝失去3个电子,故转移电子的物质的量为0.6mol,故答案为:0.2;0.6。
,反应中铝和铁系数比为1:1,故消耗了0.2molAl的同时会生成0.2mol铁,一个铝失去3个电子,故转移电子的物质的量为0.6mol,故答案为:0.2;0.6。

练习册系列答案
相关题目
【题目】下列实验结论与实验操作及现象不相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某酸雨样品中加入Ba(OH)2溶液,有白色沉淀生成 | 酸雨试样中一定含SO42- |
B | 向KI-淀粉溶液中滴入氯水,溶液变成蓝色 | I-的还原性强于Cl- |
C | 将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉 | Ba(OH)2·8H2O与NH4Cl的反应是吸热反应 |
D | 向某盐溶液中加入NaOH溶液,加热,用湿润的红色石蕊试纸放在试管口,试纸变蓝 | 该盐溶液中含有NH4+ |
A.AB.BC.CD.D




