题目内容
【题目】常温下,现有0.1molL﹣1 NH4HCO3溶液,pH=7.8.已知含氮(或含碳)各微粒的分布分数(平衡时,各微粒浓度占总微粒浓度之和的分数)与pH的关系如图所示:
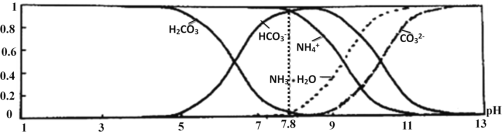
下列说法不正确的是( )
A. 分析可知,常温下Kb(NH3H2O)>Ka1(H2CO3)
B. 0.1 molL-1 NH4HCO3溶液中存在:c(NH3H2O)=c(H2CO3)+c(CO32-)
C. 当溶液的pH=9时,溶液中存在:c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-)
D. 向pH=7.8的上述溶液中逐滴滴加氢氧化钠溶液时,NH4+和HCO3﹣浓度逐渐减小
【答案】D
【解析】
A. 碳酸氢钠溶液显示碱性,根据盐的水解原理判断二者的酸碱性强弱及电离平衡常数大小。
B. 根据碳酸氢铵溶液中的物料守恒分析;
C. 当pH=9时,结合图象判断溶液中各离子浓度大小;
D. 该碳酸氢铵溶液的pH=7.8,结合图象判断滴入氢氧化钠溶液后NH4+和HCO3-浓度变化;
A. 由于0.1mol/L的NH4HCO3溶液的pH=7.8,说明碳酸氢根离子的水解程度大于铵根离子的水解程度,则Kb(NH3H2O)>Ka1(H2CO3),故A项正确;
B. 0.1mol/L的NH4HCO3溶液的pH=7.8,由图像可知,c(NH4+) = c(HCO3),又NH4HCO3溶液中存在物料守恒:c(NH4+)+ c(NH3H2O) = c(HCO3)+ c(CO32-)+ c(H2CO3),联立两式可知,c(NH3H2O)=c(H2CO3)+c(CO32-),故B项正确;
C. 结合图象可知,溶液的pH = 9时,溶液中离子浓度大小为: c(HCO3-)> c(NH4+)>c(NH3H2O)>c(CO32-),故C项正确;
D. 0.1mol/L的NH4HCO3溶液的pH=7.8,结合图像及反应原理可知,当逐滴滴加氢氧化钠溶液时,铵根离子会与氢氧根离子发生反应生成一水合氨,其浓度逐渐减小;而碳酸氢根离子由于水解显碱性,当加入氢氧化钠溶液后,开始由于抑制碳酸氢根离子的水解而使其离子浓度会先略增大,而后发生反应:HCO3- + OH- = CO32- + H2O,则使得HCO3-浓度大大减小,故D项错误;
答案选D。

 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案