题目内容
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2═NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是
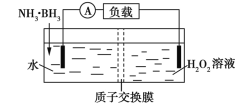
A. 正极的电极反应式为2H++2![]() ═H2↑
═H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作一段时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
【答案】D
【解析】
本题考察新型原电池工作原理,根据电池反应可知,正、负极的电极反应分别为
3H2O2+6H++6e-=6H2O、NH3·BH3+2H2O-6e-=NH4BO2+6H+。
A. 正极的电极反应式为:3H2O2+6H++6e-=6H2O,没有气体生成,A项错误;
B.原电池工作时,氢离子作为阳离子向正极移动,B项错误;
C.两电极反应分别为:3H2O2+6H++6e-=6H2O、NH3·BH3+2H2O-6e-=NH4BO2+6H+。
两极均没有气体生成,C项错误;
D.从电极反应式来看,如有6mol电子转移,则左极室质量增加31g-6g=25g,右极室质量增加6g,两极室质量之差为19g,所以当左右两室质量差为1.9g时,电路中转移0.6mol电子,D项正确;
所以答案选择D项。

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目