题目内容
【题目】下列说法中错误的是( )
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变
B.配位数为4的配合单元一定呈正四面体结构,配位数为6的配合单元一定呈正八面体结构
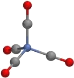
C.配位化合物Ni(CO)4结构如图,1mol分子中所含的配位键个数有8NA
D.[Pt(NH3)6]2+和[PtCl4]2-中,其中心离子的化合价都是+2
【答案】B
【解析】
A.形成配位键后,离子的颜色、溶解性和某些化学性质会发生改变,A正确;
B.配位数为4的配合单元可能呈平面四边形也可能是正四面体,故B错误;
C.每个CO分子与Ni之间形成一个配位键,这种配位键个数为4,每个CO分子中还有一个配位键,所以一个该分子含有8个配位键,1mol分子中所含的配位键个数有8NA,故C正确;
D.[Pt(NH3)6]2+中NH3整体为0价,所以Pt为+2价,[PtCl4]2-中Cl-为-1价,所以Pt为+2价,故D正确;
故答案为B。

练习册系列答案
相关题目
【题目】已知 A、B、C、D、E 五种元素都是元素周期表中前 20 号元素,原子序数依次增大,E 的外围电子排布式为 4s2。A、B、C、D 四种元素在元素周期表中的相对位置如表所示:
…… | A | ||||||
B | C | D |
根据以上信息,回答下列问题:
(1) A、D 分别与 B 形成的化合物中,________的晶格能大(填化学式)。
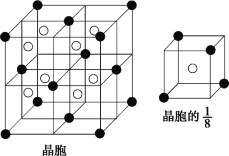
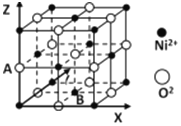
(2)A 和 E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。A 和 E 化合物的晶胞 1/8 的体积为 2.0×10-23cm3,求 A 和E 组成的离子化合物的密度为 (结果保留一位小数):________g/cm3。