题目内容
【题目】祖母绿是四大名贵宝石之一,主要成分为Be3Al2Si6O18,含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)基态Ni2+的电子排布式为_______________;宝石中Si的杂化方式是____。
(2)成键元素电负性差值越大,化学键离子性百分数越高,在卤素与Al组成的化合物中,离子性百分数最高的化合物是______(填化学式)。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是______,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的作用力类型为_________。
(4)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用Δ表示),它与中心离子的结构、电荷、配体有关。试判断分裂能Δ[Fe(H2O)63+] _____ Δ[Fe(H2O)62+](填“>”“<”或“=”),理由是__________。
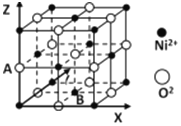
(5)氧化镍晶胞如图所示,A的原子坐标参数为:(0,0,![]() ),则底面面心B的原子坐标参数为______。
),则底面面心B的原子坐标参数为______。
【答案】1s22s22p63s23p63d8(或[Ar]3d8) sp3 AlF3 分子晶体 配位键 > Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构 (![]() ,
,![]() ,0)
,0)
【解析】
(1)Ni为28号元素,基态Ni的电子排布式为1s22s22p63s23p63d84s2,则基态Ni2+的电子排布式为1s22s22p63s23p63d8(或[Ar]3d8);宝石中Si与周围原子形成4个共价键,即宝石中Si的价层电子对数为4,则杂化方式是sp3。答案为:1s22s22p63s23p63d8(或[Ar]3d8);sp3;
(2)成键元素电负性差值越大,化学键离子性百分数越高,卤素与Al组成的化合物中,F与Al的电负性差值最大,所以离子性百分数最高的化合物是AlF3。答案为:AlF3;
(3)六羰基铬[Cr(CO)6]的沸点低,则Cr(CO)6的晶体类型是分子晶体,加热Cr(CO)6可得到高纯度铬粉和CO,反应破坏的是Cr与CO之间的配位键,所以作用力类型为配位键。答案为:分子晶体;配位键;
(4)在Fe(H2O)63+和Fe(H2O)62+中,中心原子分别为Fe3+和Fe2+,从带电荷考虑,Fe3+带正电荷高,吸引电子的能力强;从稳定性考虑,它们的价电子排布分别为3d5、3d6,3d5中轨道半充满,电子的能力低,电子跃迁所需的能量高,综合以上分析,分裂能Δ[Fe(H2O)63+]>Δ[Fe(H2O)62+],理由是:Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构。答案为:>;Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(5)由氧化镍晶胞图中A的原子坐标参数 (0,0,![]() ),可确定坐标轴的0点为左下角的坐标轴交叉点,0~A之间的距离为
),可确定坐标轴的0点为左下角的坐标轴交叉点,0~A之间的距离为![]() ,则底面面心B的原子坐标参数为(
,则底面面心B的原子坐标参数为(![]() ,
,![]() ,0)。答案为:(
,0)。答案为:(![]() ,
,![]() ,0)。
,0)。