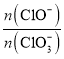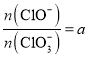题目内容
【题目】已知X元素原于的核电荷数小于18,最外层电子数等于电子层数,且比最内层电子数多1。回答下列问题:
(1)X元素的原子结构示意图为__________。
(2)X的最高价氧化物对应的水化物的化学式为___________。
(3)X的单质与NaOH溶液反应的化学方程式为__________。
【答案】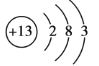 Al(OH)3 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(或为2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
Al(OH)3 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(或为2Al+2NaOH+2H2O=2NaAlO2+3H2↑)
【解析】
已知X元素原子的核电荷数小于18,最外层电子数等于电子层数,且比最内层电子数多1,则该元素原子核外电子排布为2、8、3,该元素是Al元素,然后结合其原子结构与元素位置的关系及其单质和化合物的性质分析解答。
根据上述分析可知X元素的Al元素。
(1)X是Al元素,根据元素原子核外电子排布规律可知:Al原子核外电子排布为2、8、3,所以Al原子结构示意图为: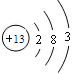 ;
;
(2) X是Al,原子核外最外层有3个电子,其最高价氧化物对应的水化物的化学式为Al(OH)3;
(3)Al能够与NaOH溶液发生反应产生Na[Al(OH)4]和H2,反应的化学方程式为2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑(或写为2Al+2NaOH+2H2O=2NaAlO2+3H2↑)。

【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g)![]() 2CH3OH(g) △H2=+23.4kJ/mol
2CH3OH(g) △H2=+23.4kJ/mol
反应Ⅲ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=_______。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子断裂2NA个H-O键,同时氢分子断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
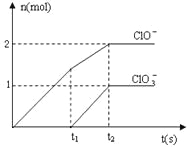
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正_______v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)%=_______%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=_______;KA、KB、KC三者之间的大小关系为________。

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%。
×100%。
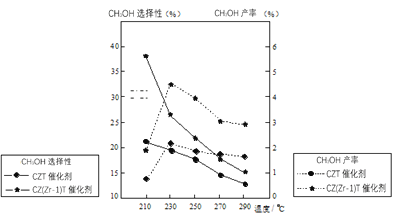
①温度高于230℃,CH3OH产率随温度升高而下降的原因是______。
②在上述条件下合成甲醇的工业条件是_______。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
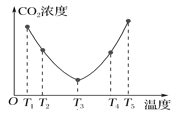
(6)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq)。为研究温度对(NH4)2CO3捕获CO2 效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图,则ΔH______0(填“>”、“=”或“<”)。