题目内容
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
2NH3(g)。设在容积为2.0L的密闭容器中充入0.60molN2(g)和1.60 mol H2(g),2min在某温度下达到平衡,此时NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。请计算(写出计算过程):
(1)2min内N2的平均速率;
(2)该条件下此反应的平衡常数K。
【答案】(1)0.1mol·L-1·min-1 (2)200
【解析】
试题分析:设达到平衡时,N2反应了x mol
则2L密闭容器在2min内各物质物质的量发生的变化如下:
N2 + 3H2 ![]() 2NH3
2NH3
起始物质的量(mol) 0.60 1.60 0
变化物质的量(mol) x 3x 2x
平衡物质的量(mol) 0.60—x 1.60—3x 2x
则:平衡时NH3的物质的量分数为:![]() 解得x=0.40mol
解得x=0.40mol
(1)![]()
(2)此温度下该反应的平衡常数![]() 。
。

练习册系列答案
相关题目
【题目】根据下列实验现象,所得结论正确的是
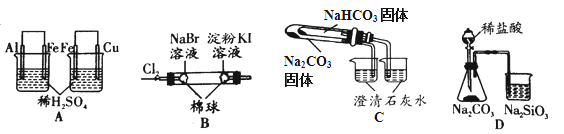
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D