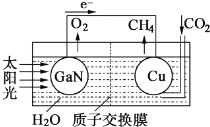
题目内容
【题目】下列有关晶体结构的说法正确的是( )
A. 金属晶体的体心立方密堆积的结构中,每个晶胞中含有2个原子
B. 通常状况下,60 g SiO2晶体中含有的分子数为NA(NA表示阿伏加德罗常数)
C. 金属铜的晶胞为面心立方晶胞,晶胞中每个铜原子的配位数为6
D. 1 mol金刚石含4 mol C—C键,金刚石网状结构中,由共价键形成的碳原子环,最小的环上有6个碳原子
【答案】A
【解析】
A.体心立方密堆积的结构中,每个晶胞中含有的原子数=1+8×![]() =2,故A正确;
=2,故A正确;
B.SiO2晶体是原子晶体,不存在分子,故B错误;
C.金属铜的晶胞为面心立方晶胞,晶胞中每个铜原子的配位数为12,故C错误;
D.1mol金刚石含有1molC原子,每个碳原子形成4×![]() =2个C-C键,因此1mol金刚石含2mol C-C键,金刚石晶体结构为
=2个C-C键,因此1mol金刚石含2mol C-C键,金刚石晶体结构为![]() ,金刚石网状结构中,由共价键形成的碳原子环,最小的环上有6个碳原子,故D错误;
,金刚石网状结构中,由共价键形成的碳原子环,最小的环上有6个碳原子,故D错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】X、Y、Z、W、R、P、Q是短周期主族元素,部分信息如下表所示:
X | Y | Z | W | R | P | Q | |
原子半径/nm | 0.154 | 0.074 | 0.099 | 0.075 | 0.143 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | -3,+5 | +3 | ||
其他 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)R在自然界中有质量数为35和37的两种核素,它们之间的关系是互为___。
(2)Z的单质与水反应的化学方程式是___;R与Q两元素最高价氧化物水化物反应的离子方程式___。
(3)Y与R相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.稳定性XR>YX4
c.Y与R形成的化合物中Y呈正价
(4)写出工业制取Y的单质的化学方程式___。
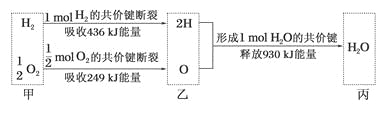
(5)反应3X2(g)+P2(g)![]() 2PX3(g)过程中的能量变化如图所示回答下列问题:
2PX3(g)过程中的能量变化如图所示回答下列问题:
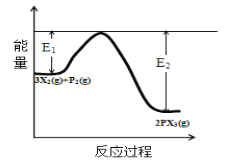
①该反应是___反应(填“吸热”“放热”);
②反应体系中加入催化剂对反应热是否有影响?___,原因是___(从能量说明)