��Ŀ����
����Ŀ����ͭת¯�̻ң���Ҫ�ɷ�ZnO����Pb��Cu��Cd��As��Cl��F��Ԫ�أ��л���п��ͭ��Ǧ��Ԫ�ؽ�����Դ�ۺ����ã�������Ҫ���塣��ͭת¯�̻��Ʊ���Ҫ����ԭ�ϻ�������п�Ĺ���������ͼ��ʾ��
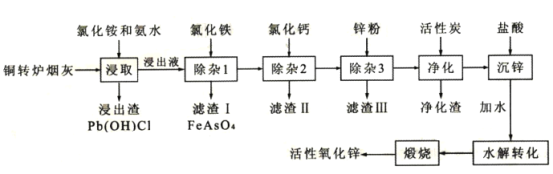
��֪������̿������Ҫ�dz�ȥ�л����ʡ�
��ش��������⣺
��1��������Һ��пԪ����[Zn(NH3)4]2+��ʽ���ڣ����ȡʱZnO������Ӧ�����ӷ���ʽΪ___��
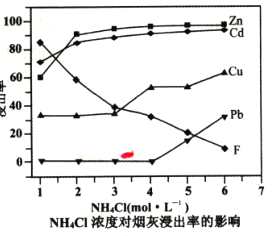
��2���ڷ�Ӧ�¶�Ϊ50�棬��Ӧʱ��Ϊlhʱ���ⶨ��Ԫ�صĽ��������Ȼ����ҺŨ�ȵĹ�ϵ��ͼ���������ͼ�������Ȼ�����˵�Ũ��Ϊ___ mo1��L-1��
��3��������Һ��c��AsO43-��=6.0��10-3molL-1���ֽ�8.0��10-3mo1L-1FeC13��Һ�����Һ�����������������������������¶�ʱKsp(FeAsO4)=2.0��10-22����Ӧ����Һ��c(AsO43-)=___mo1L-1��
��4������II����Ҫ�ɷ�Ϊ___������3���û����ӹ��̣���˹�����Ҫ��ȥ�Ľ�����___���ѧʽ����
��5����п�õ�������ΪZn(NH3)2C12����д��ˮ��ת���Ļ�ѧ����ʽ___��
��6���������п���ѭ��ʹ�õ����ʵĵ���ʽΪ___��
��7��ȡmg��������п��Ʒ��Ԥ��������ɴ���Һ������ָʾ��3��4�Σ��ټ����������Ǽ��İ�����amolL-1EDTA��Һ���еζ������ı�ҺVmL����֪����1.0mLEDTA��Һ[c(EDTA)=1.000mo1L-1]�൱���Կ˱�ʾ������п����Ϊ0.08139������Ʒ������п����������Ϊ___���ô���ʽ��ʾ����
���𰸡�ZnO+2NH4++2NH3H2O=[Zn(NH3)4]2++3H2O 4 2.0��10-19 CaF2 Cu��Cd Zn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl 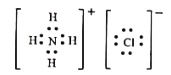
![]() ��100%��
��100%��![]() %
%
��������
�������Ȼ�狀Ͱ�ˮ��ȡ�̻ң���пԪ��ת��Ϊ![]() �����ӣ������Ȼ������飬�����Ȼ��ƿ��Եõ�
�����ӣ������Ȼ������飬�����Ȼ��ƿ��Եõ�![]() ������өʯ��������п�ۿ��Խ�������������ȫ���û������õ�����III���������̿��ȥ�л����ʣ��������Ὣпת��Ϊ
������өʯ��������п�ۿ��Խ�������������ȫ���û������õ�����III���������̿��ȥ�л����ʣ��������Ὣпת��Ϊ![]() �����õ�����п���ݴ����������⼴�ɡ�
�����õ�����п���ݴ����������⼴�ɡ�
��1��������Ŀ��Ϣ�����ӷ���ʽΪ![]() ��������̿��Դӵ���غ�ĽǶ�����ƽ��
��������̿��Դӵ���غ�ĽǶ�����ƽ��
��2���۲���ͼ�����Ȼ�淋�Ũ��Ϊ4mol/Lʱ��һ����пԪ�صĽ������Ѿ��ӽ�100%���������Ȼ��Ũ��û��̫�����壬��һ������Ũ���ٸߣ�ǦԪ�ؽ�������Һ������ȫ��ȥǦ��
��3���������Ϻ��൱���������ӵ�Ũ�ȶ���Ϊһ�룬��![]() ��
��![]() ��������������1:1�����ģ��跴Ӧ��
��������������1:1�����ģ��跴Ӧ��![]() Ũ��Ϊ
Ũ��Ϊ![]() ������
������![]() �����
�����![]() ��
��
��4�����ݷ���������IIΪ![]() ��������3��Ҫ���Գ�ȥ��Һ�е�
��������3��Ҫ���Գ�ȥ��Һ�е�![]() ��
��![]() ��
��
��5����Ȼ���պ�õ�![]() ��������ǰ��ȻΪ
��������ǰ��ȻΪ![]() ����ˮ�����Ϊ
����ˮ�����Ϊ![]() ���ݴ���д������ʽZn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl��
���ݴ���д������ʽZn(NH3)2Cl2+2H2O=Zn(OH)2��+2NH4Cl��
��6��ˮ���õ����Ȼ�泥��ֿ������ڵ�һ���Ľ�ȡ������ѭ�����ã������ʽΪ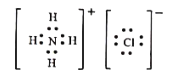 ��
��
��7������![]() �����EDTA��������Ϊ
�����EDTA��������Ϊ![]() ����ЩEDTA��Ӧ������п������Ϊ
����ЩEDTA��Ӧ������п������Ϊ![]() �ˣ��������п����������Ϊ
�ˣ��������п����������Ϊ![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�