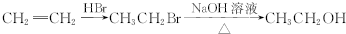题目内容
10.已知反应:2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,完成以下问题,(1)将该反应方程式改写成离子方程式.
(2)标出该反应中电子转移的方向和数目.
2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O,
(3)取15.8克KMnO4溶解于水配成100毫升溶液,所得溶液的物质的量浓度是1mol/L.用15.8克KMnO4与足量盐酸反应可以生成标准状况下氯气5.6L.在此过程中被氧化的HCl的物质的量是0.5mol.
分析 2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,结合化合价的变化以及电子转移数目相等的计算.
解答 解:(1)反应的离子方程式为2KMnO4+16H++10Cl-═2Mn2++5Cl2↑+8H2O,故答案为:2KMnO4+16H++10Cl-═2Mn2++5Cl2↑+8H2O;
(2)2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O中Mn元素化合价降低,被还原,KMnO4为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,反应中Mn得到2×5e-,Cl失去10e-,电子转移数目和方向可表示为 ,
,
故答案为: ;
;
(3)n(KMnO4)=$\frac{15.8g}{158g/mol}$=0.1mol,c(KMnO4)=$\frac{0.1mol}{0.1L}$=1mol/L,
2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O
2mol 5×22.4L
0.1mol V
V=5.6L,
由方程式可知被氧化的HCl的物质的量为0.5mol,
故答案为:1mol/L;5.6L;0.5mol.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,为高频考点,注意把握元素化合价的变化,能会用双线桥法表示电子转移的方向和数目,难度不大.

练习册系列答案
相关题目
20.下列有关化学实验的叙述正确的是( )
| A. | 用待测液润洗滴定用的锥形瓶 | |
| B. | 常温下,某同学用pH试纸测得KCl溶液的pH约为7.0 | |
| C. | 配制Fe2(SO4)3溶液时,先把Fe2(SO4)3晶体溶于浓硫酸后稀释 | |
| D. | 用碱式滴定管准确移取KMnO4溶液,体积为21.50mL |
1.下列描述中正确的是( )
| A. | CS2为V形的极性分子 | |
| B. | ClO3- 的空间构型为平面三角形 | |
| C. | SF6中S原子和氟原子均满足最外层8电子稳定结构 | |
| D. | SiF4和SO32-的中心原子均为sp3杂化,SiF4分子呈空间正四面体,SO32-呈三角锥形 |
18.CuSO4•5H2O是配合物,显蓝色,其溶液加入NH3后变深蓝,加入乙醇后有晶体析出,则下列说法不正确的是( )
| A. | H2O作配体时,Cu与H2O形成σ键 | B. | H2O的配位能力大于NH3 | ||
| C. | 乙醇可减小离子晶体的溶解度 | D. | Cu(NH3)4SO4遇BaCl2有白色沉淀生成 |
5.在同温同压下,两个容积相同的储气瓶,一个装满O2,另一个装满CH4,以下有关两瓶气体的计算不正确的是( )
| A. | O2与CH4质量比为 2:1 | B. | O2与CH4原子数之比为 1:1 | ||
| C. | O2与CH4密度比为2:1 | D. | O2与CH4分子数之比为1:1 |
15.填写下面的表格,从这些数据中得出有用的结论:
结论:当质量以g为单位时,
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
①1mol任何原子的质量在数值上都等于相对原子质量;
②1mol任何分子的质量在数值上都等于这种分子的相对分子质量;
③1mol任何离子的质量在数值上都等于这种离子的相对原子质量.
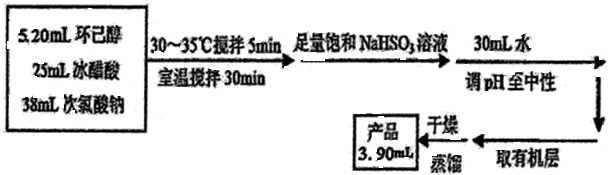
5. 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
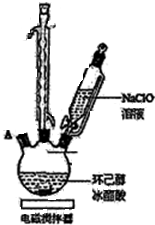
有关物质信息、实验流程及实验装置如图:
实验使用的NaClO溶液的浓度是1.8mol/L
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为 .
.
(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管( ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
有关物质信息、实验流程及实验装置如图:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |

(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为
 .
.(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管(
 ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
3. (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
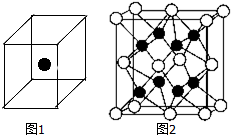
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
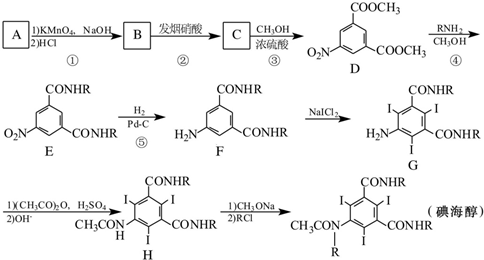
 .
. 、
、 .
.
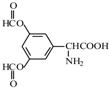
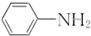 呈弱碱性,易被氧化
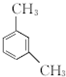
呈弱碱性,易被氧化 和(CH3CO)2O为原料制备染料中间体
和(CH3CO)2O为原料制备染料中间体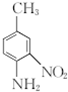 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: