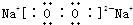题目内容
15.由相同条件下的三个反应:2A-+B2═2B-+A2 2C-+A2═2A-+C22B-+D2═2D-+B2
判断下列说法正确的是( )
| A. | 氧化性:A2>B2>C2>D2 | B. | 还原性:A->B->C->D- | ||
| C. | 2A-+D2═2D-+A2反应可以进行 | D. | 2C-+B2═2B-+C2反应不能进行 |
分析 由2A-+B2═2B-+A2氧化性:B2>A2,还原性:A->B-;由2C-+A2═2A-+C2氧化性:A2>C2,还原性:C->A-;2B-+D2═2D-+B2氧化性:D2>B2,还原性:B->D-;所以氧化性:D2>B2>A2>C2;还原性:C->A->B->D-;
A、氧化剂的氧化性强于氧化产物;
B、还原剂的还原性强于还原产物;
C、强氧化剂能制弱氧化剂;
D、强氧化剂能制弱氧化剂.
解答 解:由2A-+B2═2B-+A2氧化性:B2>A2,还原性:A->B-;由2C-+A2═2A-+C2氧化性:A2>C2,还原性:C->A-;2B-+D2═2D-+B2氧化性:D2>B2,还原性:B->D-;所以氧化性:D2>B2>A2>C2;还原性:C->A->B->D-;
A、氧化性:D2>B2>A2>C2,故A错误;
B、还原性:C->A->B->D-,故B错误;
C、D2的氧化性强于A2,所以2A-+D2═2D-+A2反应可以进行,故C正确;
D、因为氧化性:B2>C2,所以2C-+B2═2B-+C2反应能进行,故D错误;
故选C.
点评 本题考查氧化还原反应中的氧化性和还原性强弱和反应的自发的性问题,综合性强,有一定的难度.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
5.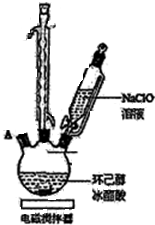 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
有关物质信息、实验流程及实验装置如图:
实验使用的NaClO溶液的浓度是1.8mol/L
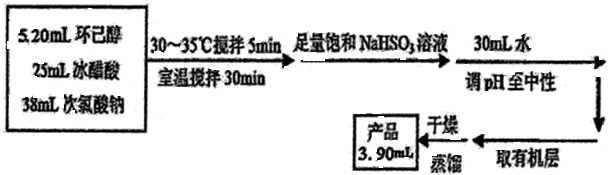
(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为 .
.
(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管( ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)
A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
 环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
环己酮是重要化工原料,可用于制造尼龙、己二酸产品.可以尝试用次氯酸钠氧化环己醇制备环己酮:
有关物质信息、实验流程及实验装置如图:
| 密度g/cm3 | 沸点℃ | 熔点℃ | 水溶性 | |
| 乙酸 | 1.05 | 117.9 | 16.6 | 易溶 |
| 环己醇 | 0.96 | 160.8 | 25.9 | 微溶 |
| 环己酮 | 0.95 | 155 | -4.5 | 能溶 |

(1)实验中盛装NaClO溶液的仪器比普通分液漏斗多了一个侧管,此设计的目的为平衡气压,使液体可以顺利流下.
(2)次氯酸钠氧化环己醇的反应放出大量的热,为了将体系温度维持在30~35℃,除了用冰水水浴冷却外,采取的措施还可能有缓慢滴加NaClO溶液或电磁搅拌器搅拌等,并应在三颈瓶的A端口处应补加温度计(仪器名称).
(3)实验过程中NaClO溶液氧化环己醇的化学方程式为
 .
.(4)为将溶液的pH调至中性,可以加入的试剂是碳酸钠或氢氧化钠等.
(5)在实验过程中,获得产品的蒸馏操作中不可使用水冷凝管,而应使用空气冷凝管(
 ),其最可能的原因是A(填写选项编号)
),其最可能的原因是A(填写选项编号)A、防止因温差过大,水冷凝管易炸裂
B、空气冷凝管结构简单,易于安装
C、空气冷凝管冷凝效果更佳
(6)计算本实验过程中环己酮的产率75.7%.
6.在常温下,下列有关溶液中微粒的物质的量浓度关系正确的是( )
| A. | 1L0.1mol•L-1(NH4)2Fe(SO4)2•6H2O的溶液中:c(NH4+)+c(Fe2+)+c(H+)═c(OH-)+c (SO42-) | |
| B. | 0.1 mol•L-1 NH4HS溶液中:c(NH4+)<c(HS-)+c(H2S)+c(S2-) | |
| C. | 0.1mol•L-1pH为4的NaHA溶液中:c(HA-)>c(H2A)>c(A2-) | |
| D. | 等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:c(OH-)+c(CO32-)═c(HCO3-)+c(H2CO3)+c(H+) |
3. (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
请回答下列问题:
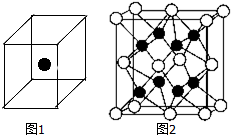
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
①比较下列两组物质的熔点高低(填“>”、“<”或“=”):SiC>Si;SiCl4<SiO2.
②如图1立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子.
③工业上高纯硅可通过下列反应制取:
SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236kJ/mol.
(2)化合物Na2O的晶胞如图2.其中O2-离子的配位数为8.该化合物与MgO相比,熔点较高的是MgO.(填化学式)
③已知该化合物的晶胞边长为a pm,则该化合物的密度为$\frac{248}{a{N}_{A}×1{0}^{-30}}$g•cm-3(只要求列出算式,不必计算出数值,阿伏加德罗常数的数值为NA).
10.1g干冰中含氧原子a个,则阿伏加德罗常数的值是( )
| A. | 22a | B. | 28a | C. | 18a | D. | 17a |
20.下列反应中,既是离子反应,又是氧化还原反应的是( )
| A. | CaCO3+HCl | B. | Ag NO3+NaCl | C. | Fe+CuSO4 | D. | NaOH+H2SO4 |
5.关于给定的原电池的下列说法中,错误的是( )


| A. | 铜片作正极,锌片作负极 | |
| B. | 该电池工作时,锌失电子变为Zn2+进入溶液 | |
| C. | 该电池工作时,电子由锌片流向铜片 | |
| D. | 该电池工作时,H+在锌片上得电子被还原生成H2逸出 |
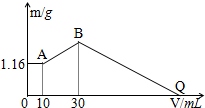 把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答:
把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后有1.16g白色沉淀,在所得的悬浊液中逐滴加入1mol/LHCl溶液,加入HCl溶液的体积V与生成沉淀的质量m的关系如图所示.试回答: