题目内容
【题目】按照下列元素基态原子的电子排布特征判断元素,并回答问题:
A原子中只有一个电子层且只含有一个电子;B原子的3p轨道上得到一个电子后不能再容纳外来电子;C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他电子的自旋方向相反;D原子的第三电子层上有8个电子,第四层上只有1个电子;E原子的价电子排布式为3s23p6。
(1)以下分别是哪种元素(用元素符号填空):
A:_____________;C:_____________;D:____________;
(2)B原子的核外电子排布式_____________;写出A的负一价阴离子的电子式_____________。
(3)E的原子结构示意图_____________。
(4)写出由A、C两元素形成的18e-分子的形成过程:_____________
【答案】H O K 1s22s22p63s23p5 〔:H〕- ![]() 2H·+2
2H·+2![]() →
→![]()
【解析】
由条件不难推出A为H元素;由条件“B原子的3p轨道上得到一个电子后不能再容纳外来电子”可知,B原子3p轨道上有5个电子,所以B为Cl元素;由条件“C原子的2p轨道上有一个电子的自旋方向与2p轨道上其他原子的自旋方向相反”结合洪特规则和泡利不相容原理分析可知,C原子2p轨道上有4个电子,所以C元素为O元素;由条件不难推出D元素即为K元素;由E原子的价电子排布式可知,E元素为Ar元素。
(1)通过分析可知,A为H元素,C为O元素,D为K元素;
(2)通过分析可知,B为Cl元素,所以核外电子排布式为1s22s22p63s23p5;A为H元素,所以负一价阴离子的电子式为:![]() ;
;
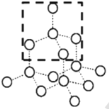
(3)E为Ar元素,所以,原子结构示意图即为![]() ;
;
(4)A为H,C为O,形成的18e-分子即为H2O2,所以形成过程为:
2H·+2![]() →
→![]() 。
。

【题目】向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:___
a与b的关系 | 生成沉淀的质量(g) |
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少___?