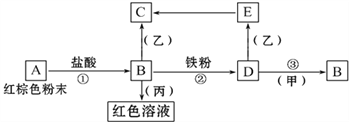
题目内容
【题目】向50mLbmol/L的AlCl3溶液中加入50mLamol/L的NaOH溶液。
(1)当a、b关系不同时,反应所生成沉淀的质量不同。填写下表:___
a与b的关系 | 生成沉淀的质量(g) |
(2)若b=1mol/L时,要生成沉淀3.12g,则a值等于多少___?
【答案】
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
2.4或3.2
【解析】
50mLbmol/L的AlCl3的物质的量为50×10-3L×bmol/L=0.05 bmol, 50mLamol/L的NaOH溶液物质的量为50×10-3L×amol/L=0.05 amol。
AlCl3和NaOH溶液反应可能生成Al(OH)3或NaAlO2,AlCl3溶液中加入NaOH溶液的反应过程为:AlCl3+3NaOH=Al(OH)3↓,Al(OH)3+NaOH= NaAlO2+2H2O,总反应:AlCl3+4NaOH= NaAlO2+2H2O。可在此基础上进行讨论。
(1)根据反应AlCl3+3NaOH=Al(OH)3↓,AlCl3过量和恰好完全生成Al(OH)3时,NaOH全部用于生成沉淀,关系为:0.05bmol×3≥0.05amol,a≤3b,生成的沉淀质量为0.05amol×![]() ×78gmol-1=1.3ag;根据反应AlCl3+4NaOH= NaAlO2+2H2O,恰好完全生成NaAlO2 和NaOH过量时,关系为:0.05bmol×4=0.05amol,a≥4b,此时无沉淀;当4b>a>3b 时,分两步计算:
×78gmol-1=1.3ag;根据反应AlCl3+4NaOH= NaAlO2+2H2O,恰好完全生成NaAlO2 和NaOH过量时,关系为:0.05bmol×4=0.05amol,a≥4b,此时无沉淀;当4b>a>3b 时,分两步计算:
第一步,AlCl3完全沉淀,生成Al(OH)30.05bmol,消耗NaOH0.05bmol×3=0.15bmol;第二步,沉淀部分溶解:

n=(0.05a-0.15b)mol
则未溶的沉淀质量为:[0.05bmol-(0.05a-0.15b)mol]×78gmol-1=(15.6b-3.9a)g。
综上所述,当a、b关系不同时,反应所生成沉淀的质量如下表:
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
答案为:
a与b的关系 | 生成沉淀的质量(g) |
a≤3b | 1.3a |
4b>a>3b | 15.6b-3.9a |
a≥4b | 0 |
(2) 若b=1mol/L时,a=要生成沉淀3.12g讨论如下:
a≤3b=3时,1.3a=3.12,a=2.4<3,答案合理;4b>a>3b即4>a>3时,15.6b-3.9a=15.6-3.9a=3.12,a=3.2,4>3.2>3,答案合理。
答案为:2.4或3.2