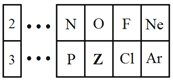
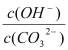��Ŀ����
����Ŀ����1����������A��B����Ӧ��
A: 2NaOH+H2SO4=Na2SO4+2H2O��B:Zn+H2SO4=ZnSO4+H2��
��A��B��Ӧ����Ƴ�Ϊԭ��ص���____(�A����B��)��
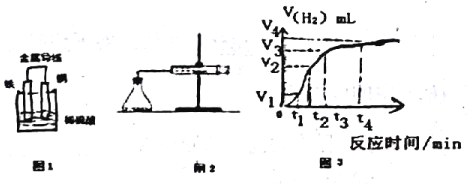
��2��ijԭ���ʾ��ͼ��ͼ1����õ�ظ����缫�ķ�Ӧ����ʽΪ_______________��
��3�����õ�ط�Ӧ�����й���0.3mol���ӷ���ת�ƣ������ɵ���������ڱ�״���µ������_____L��
��4��Ϊ���о�Fe��ϡH2SO4��Ӧ�����ʣ�ijͬѧͨ����ͼ2ʵ��װ�òⶨ��Ӧ�����ɵ�H2�������������ͼ3��ʾ�����ߣ��ڸ�ʵ������з�����ƿ�¶����ߡ���ش��������⡣
��0��tl��tl��t2��t2��t3����ʱ������Ӧ��������ʱ�����____����������������ܵ�ԭ����_____����ʵ��������ռ���������������______ʱ���ڡ�
��5��Ϊ�˼����÷�Ӧ�����ʣ�����Ϊ���еķ�����________��
A����H2SO4��Һ�м�����ˮ B����FeƬ�ij�Fe��
C����H2SO4��Һ�м�Na2SO4��Һ D����H2SO4��Һ�е��뼸��Cu(NO3)2��Һ��
���𰸡� B Zn ��2e��==Zn2+ 3.36 t1��t2 �÷�Ӧ�������ӿ컯ѧ��Ӧʱ���� t1��t2 A��C
����������1��A���кͷ�Ӧ��û�е���ת�ƣ��������Ϊԭ��أ�B���û���Ӧ������������ԭ��Ӧ���������Ϊԭ��أ���2��п�Ľ�����ǿ��ͭ��п�Ǹ�������õ�ظ����缫�ķ�Ӧ����ʽΪ Zn��2e����Zn2+����3�������������ӷ����õ����ӵĻ�ԭ��Ӧ�����õ�ط�Ӧ�����й���0.3mol���ӷ���ת�ƣ������ɵ�������0.15mol���ڱ�״���µ������0.15mol��22.4L/mol��3.36L����4������б��Խ��Ӧ����Խ�죬��Ӧ��������ʱ�����t1��t2����������������ܵ�ԭ���Ǹ÷�Ӧ���ȣ��¶����ӿ컯ѧ��Ӧʱ���ʣ������������֪��ʵ��������ռ���������������t1��t2ʱ���ڡ���5��A����H2SO4��Һ�м�����ˮ������Ũ�Ƚ��ͣ���Ӧ���ʼ�С��A��ȷ��B����FeƬ�ij�Fe������Ӧ��Ӵ��������Ӧ���ʼӿ죬B����C����H2SO4��Һ�м�Na2SO4��Һ�൱��ϡ�ͣ�������Ũ�ȼ�С����Ӧ���ʼ�С��C��ȷ��D����H2SO4��Һ�е��뼸��Cu(NO3)2��Һ����������Һ�����������ǿ�����ԣ��ͽ�����Ӧ�ò���������D����ѡAC��

����Ŀ���Ȼ���ͭ��CuCl���㷺���ڻ�����ӡȾ���л��ϳɵ���ҵ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ���ڳ�ʪ��������ˮ���������Ժ���ͭ����Ҫ�ɷ���Cu������CuO��Ϊԭ�ϣ���������������ֽ⼼�������Ȼ���ͭ�Ĺ��չ�������ͼ��ʾ��

�ش��������⣺
��1��CuCl��CuԪ�������ڱ��е�λ��Ϊ___________��
��2���������NԪ�ر���ԭΪ��ͼۣ���Cu�ܽ�����ӷ���ʽΪ________���ܽ��¶�Ӧ������60~70�棬ԭ����______________��
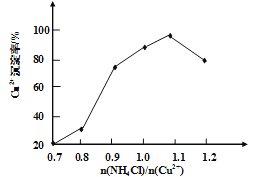
��3��д�����������Ҫ��Ӧ�����ӷ���ʽ________��(NH4)2SO3Ҫ�ʵ�������Ŀ���У���֤Cu2+�Ļ�ԭ���ʣ�__________����֪NH4Cl��Cu2+�����ʵ���֮��![]() ��Cu2+�����ʵĹ�ϵ��ͼ��ʾ�����Ȼ���������ӵ�һ��Ũ�Ⱥ��Ȼ���ͭ�ij����ʼ��٣�ԭ����________��
��Cu2+�����ʵĹ�ϵ��ͼ��ʾ�����Ȼ���������ӵ�һ��Ũ�Ⱥ��Ȼ���ͭ�ij����ʼ��٣�ԭ����________��
��4����������Ҵ�ϴ�ӵ�Ŀ����__________��
��5���Ȼ���ͭ�Ķ���������
�ٳ�ȡ��Ʒ0.250g��10mL������FeCl3��Һ��250mL��ƿ�У�����ܽ⣻
����0.100mol��L��1������[Ce(SO4)2]����Һ�ⶨ����֪��CuCl+FeCl3=CuCl2+FeCl2��Fe2++Ce4+=Fe3++Ce3+��
����ƽ��ʵ�������±���ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.250g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 |
����Ʒ��CuCl�Ĵ���Ϊ_______���������3λ��Ч���֣���
����Ŀ��N2O5��һ���¶��¿ɷ������з�Ӧ��2N2O5(g)![]() 4NO2(g)��O2(g) ��H>0��T1�¶��µIJ���ʵ������Ϊ��
4NO2(g)��O2(g) ��H>0��T1�¶��µIJ���ʵ������Ϊ��
t/s | 0 | 500 | 1 000 | 1 500 |
c(N2O5)/mol/ L | 5.00 | 3.52 | 2.50 | 2.50 |
����˵������ȷ����( )
A. 500 s��N2O5�ֽ�����Ϊ2.96��10��3mol/(L��s)
B. T1�¶��µ�ƽ�ⳣ��ΪK1��125��1 000 sʱת����Ϊ50%
C. ������������ʱ��T2�¶��·�Ӧ��1 000 sʱ���N2O5(g)Ũ��Ϊ2.98 mol/L����T1<T2
D. T1�¶��µ�ƽ�ⳣ��ΪK1��T3�¶��µ�ƽ�ⳣ��ΪK3����K1>K3����T1>T3