题目内容
【题目】元素R、T、X、Y、Z在元素周期表中的相对位置如下图所示,其中Z单质与H2混合遇强光会发生爆炸。则下列判断错误的是
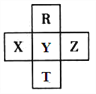
A. 原子半径 Z>Y>R
B. R与Y的电子数相差8
C. 非金属性:Z>Y>X
D. HZO4是目前无机酸中最强的含氧酸
【答案】A
【解析】根据Z单质与H2混合遇强光会发生爆炸可知Z为氯,由元素在周期表中的位置可知,R、X、Y、T分别是氧、磷、硫、硒。A.同周期元素从左到右原子半径逐渐减小,所以原子半径Z<Y,故A错误;B.R与Y的电子数相差8,故B正确;C.同周期元素从左到右非金属性逐渐增强,所以非金属性:Z>Y>X ,故C正确;D.非金属性比氯强的氟、氧没有含氧酸,所以 HClO4是目前无机酸中最强的含氧酸,故D正确。故选A。

【题目】已知硫铁矿的主要成分是FeS2(铁元素呈+2价,硫元素呈—1价)。以下是分析硫铁矿中FeS2含量的三种方法,各方法的操作流程图如下:
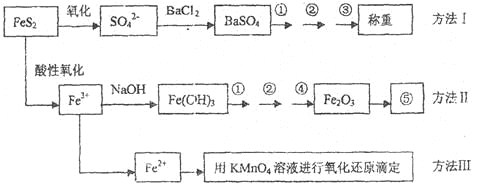
请同答下列问题:
(1)流程图中操作①、②、③分别指的是:①____________、②___________、③________。
操作④、⑤用到的主要仪器是:④_________、⑤__________(每空填1~2个仪器)。
(2)判断溶液中SO42-离子己沉淀完全的方法是______________________________________。
(3)某同学用方法Ⅲ测定试样中Fe元素的含量,需要准确配制KMnO4标准溶液,下列因素导致所配制的溶液浓度偏大的有
A.砝码生锈 | B.定容时俯视 |
C.称量时物质和砝码位置反了(需要游码) | D.容量瓶用待装液润 |
(4)某同学采用方法Ⅱ分析矿石中的Fe含量,发现测定结果总是偏高,则产生误差的可能原因是______________________________________。
(5)称取矿石试样1.60g,按方法Ⅰ分析,称得BaSO4的质量为4.66g,假设矿石中的硫元素全部来自于FeS2,则该矿石中FeS2的质量分数是_________________________。
【题目】25℃时,三种酸的电离平衡常数如下表所示。
化学式 | CH3COOH | HClO | H3PO3 |
名称 | 醋酸 | 次氯酸 | 亚磷酸 |
电离平衡常数 | 1.8×10-5 | 3.0×10-8 | K1=8.3×10-3 K2=5.6×10-6 |
回答下列问题:
(1)浓度均为0.1mol/L的CH3COOH、HClO、 H3PO3溶液中,c(H+)最小的是__________。
(2)亚磷酸(H3PO3)为二元酸,具有较强的还原性。H3PO3的电离方程式为___________。Na2HPO3是________(填“酸式盐”“碱式盐”或“正盐”)。
(3)常温下,0.1mol/L的CH3COOH溶液加水稀释的过程中,下列表达式的数值一定变大的是_______(填字母)。
A.c(H+) B.![]() C.c(CH3COO- ) D.c(CH3COOH)
C.c(CH3COO- ) D.c(CH3COOH)
(4)体积均为10mL、c(H+)均为10-2mol/L的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中c(H+)的变化如图所示,则HX的电离平衡常数_________(填“大于”“小于”或“等于”)醋酸的电离平衡常数。