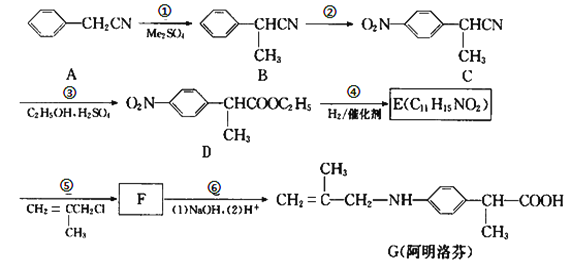
题目内容
【题目】七铝十二钙(12CaO·7Al2O3)是新型的超导材料和发光材料,用白云石(主要含CaCO3)和铝矿渣(主要含Al2O3和SiO2)制备七铝十二钙的工艺如下:
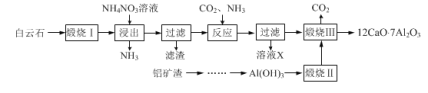
已知“煅烧Ⅲ”时发生反应为:12CaCO3+7Al2O3![]() 12CaO·7Al2O3+12CO2↑
12CaO·7Al2O3+12CO2↑
(1)写出“浸出”过程中CaO与NH4NO3溶液反应的化学方程式:___。
(2)检验“浸出”过程中有NH3生成的方法是:___。
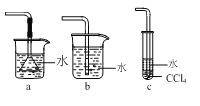
(3)如图所示装置中可用于实验室吸收NH3的是___(填字母)。
(4)溶液X中所含主要溶质的化学式为____。
(5)设计由铝矿渣制取Al(OH)3的方法,并简述过程:___。
【答案】CaO+2NH4NO3=Ca(NO3)2+2NH3↑+H2O 在“浸出”容器上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成(或用蘸有浓盐酸的玻璃棒放在“浸出”容器上方,看到白烟,证明有氨气生成) c NH4NO3 向铝矿渣中加入盐酸、搅拌,过滤得到AlCl3溶液,再向AlCl3溶液通入过量NH3、过滤、洗涤得到Al(OH)3
【解析】
白云石煅烧发生反应:CaCO3![]() CaO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,CaO是碱性氧化物,能与水反应生成Ca(OH)2,由于反应放热,并且NH4NO3能与Ca(OH)2发生复分解反应生成Ca(NO3)2、NH3和H2O,NH3逸出,过滤得到Ca(NO3)2溶液,将CO2和NH3通入Ca(NO3)2溶液中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,过滤得到CaCO3固体和X,X主要成分为NH4NO3;
CaO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,CaO是碱性氧化物,能与水反应生成Ca(OH)2,由于反应放热,并且NH4NO3能与Ca(OH)2发生复分解反应生成Ca(NO3)2、NH3和H2O,NH3逸出,过滤得到Ca(NO3)2溶液,将CO2和NH3通入Ca(NO3)2溶液中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,过滤得到CaCO3固体和X,X主要成分为NH4NO3;
盐酸溶解铝矿渣(主要含Al2O3和SiO2)得到AlCl3和SiO2,过滤除去SiO2得到AlCl3溶液,向AlCl3溶液通入过量NH3、过滤得到Al(OH)3,加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙,据此分析解答。
(1)CaO是碱性氧化物,能与水反应生成Ca(OH)2,由于反应放热,并且NH4NO3能与Ca(OH)2发生复分解反应生成Ca(NO3)2、NH3和H2O,所以总反应方程式为CaO+2NH4NO3=Ca(NO3)2+2NH3↑+H2O;
(2)NH3是碱性气体,可用湿润的红色石蕊试纸检验,石蕊试纸变蓝,方法为:在“浸出”容器上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成,或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成;
(3)NH3极易溶于水,可用水吸收,但需要注意防倒吸,a、b两装置易出现倒吸现象,c能防倒吸,故答案为:c;
(4)将CO2和NH3通入Ca(NO3)2溶液中发生反应为:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,所以溶液X主要成分为NH4NO3;
(5)铝矿渣主要为Al2O3和SiO2,可用盐酸溶解,过滤除去SiO2、得到AlCl3溶液,向AlCl3溶液通入过量NH3、过滤得到Al(OH)3,
故答案为:向铝矿渣中加入盐酸、搅拌,过滤得到AlCl3溶液,再向AlCl3溶液通入过量NH3、过滤、洗涤得到Al(OH)3。

【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g)其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=______________
(2)该反应为_______反应(选填吸热、放热);
(3)下列能使CO2的转化率增加的是___________________
(a)增大压强 (b)增加CO2的含量
(c)分离出产物H2O (d)升高温度
(4)830K时,若起始时:c(CO2)=2mol/L,c(H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为_________________
(5)能判断该反应是否达到化学平衡状态的依据是___________。
(a)容器中压强不变 (b)混合气体中 c(CO)不变
(c)v正(H2)=v逆(H2O) (d)混合气体的摩尔质量不变
【题目】下列是某同学对相应反应的离子方程式所作的评价,其中评价合理的是()
编号 | 化学反应 | 离子方程式 | 评价 |
| 碳酸钙与醋酸反应 |
| 错误,碳酸钙是弱电解质,不应写成离子形式 |
| 向 |
| 错误,碱过量,应生成 |
|
|
| 正确 |
| 等物质的量的 |
| 正确 |
A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()