��Ŀ����
����Ŀ���ش��������⣺
��1����֪������CO��ȼ����Ϊ283kJ/mo1����CO��ȼ���ȵ��Ȼ�ѧ����ʽΪ____��
��2����ҵ������CO��H2�ϳ������ԴCH3OH���䷴ӦΪ��CO(g)+2H2(g)![]() CH3OH(g) ��H=-116kJ/mo1
CH3OH(g) ��H=-116kJ/mo1
��ͼ��ʾCO��ƽ��ת����(��)���¶Ⱥ�ѹǿ�仯��ʾ��ͼ��
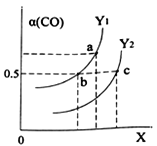
X��ʾ����_____��Y1___Y2(����<������=������>��)��
��3���ϳɼ״��ķ�Ӧԭ��Ϊ��CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g)����1L���ܱ������У�����1mol CO2��3mol H2����500���·�����Ӧ�����CO2(g)��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
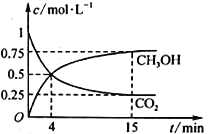
�ٷ�Ӧ���е�4minʱ��v(��)___v(��)(����>����<������=��)��0~4min��CO2��ƽ����Ӧ����v(CO2)=_____mol��L1��min1��
�ڸ��¶���ƽ�ⳣ��Ϊ____��
��������˵���÷�Ӧ�Ѵﵽƽ��״̬����____��
A��v��(CH3OH)=3v��(H2)
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1
C�����º�ѹ�£������������ٱ仯
D�����º����£�������ܶȲ��ٱ仯
���𰸡�CO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125mol��L1��min1 5.33(��5.3��16/3) C
CO2(g) ��H=-283kJ/mo1 ѹǿ < > 0.125mol��L1��min1 5.33(��5.3��16/3) C
��������
��1����һ�������£�1mol��ȼ����ȫȼ�������ȶ�������ʱ���ų���������ȼ���ȣ���֪������CO��ȼ����Ϊ283kJ/mo1����CO��ȼ���ȵ��Ȼ�ѧ����ʽΪCO(g)+1/2O2(g)![]() CO2(g) ��H=-283kJ/mo1��
CO2(g) ��H=-283kJ/mo1��
��2����X������CO��ƽ��ת����������˵��ƽ��������Ӧ������У���������Ӧ�������С�ķ��ȵĿ��淴Ӧ����X��ʾ����ѹǿ����ͬѹǿ�£������¶�ƽ�����淴Ӧ������У�CO��ƽ��ת���ʼ�С�����Y1��Y2��
��3���ٷ�Ӧ���е�4minʱ������̼��Ũ����Ȼ�ڼ�С��˵��ƽ��������Ӧ������У����v(��)��v(��)��0��4min�����Ķ�����̼Ũ����1.0molL��0.5mol��0.5mol/L����CO2��ƽ����Ӧ����v(CO2)=0.5mol/L��4min=0.125mol��L1��min1��
�ڸ��ݷ���ʽ��֪
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
��ʼŨ�ȣ�mol/L�� 1 3 0 0
ת��Ũ�ȣ�mol/L�� 0.75 2.25 0.75 0.75
ƽ��Ũ�ȣ�mol/L�� 0.25 0.75 0.75 0.75
����¶���ƽ�ⳣ��Ϊ![]() ��
��
��A��v��(CH3OH)=3v��(H2)���淴Ӧ���ʲ���ȣ�û�дﵽƽ��״̬��A����
B��CO2��H2��CH3OH��H2OŨ��֮��Ϊ1��3��1��1����˵�����淴Ӧ������ȣ���һ���ﵽƽ��״̬��B����
C������Ӧ�����С�����º�ѹ�£������������ٱ仯˵�����淴Ӧ������ȣ��ﵽƽ��״̬��C��ȷ��
D���ܶ��ǻ�����������������ݻ��ı�ֵ���ڷ�Ӧ�������������ݻ�ʼ���Dz���ģ�����º����£�������ܶȲ��ٱ仯����˵����Ӧ�ﵽƽ��״̬��D����
��ѡC��