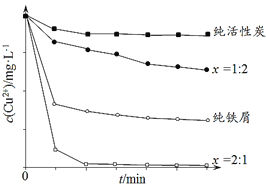
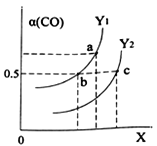
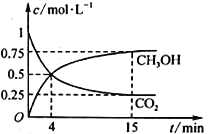
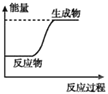
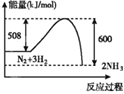
��Ŀ����
����Ŀ���������£�����������Һ����0.1 mol��L-1 NH4Cl��Һ����0.1 mol��L��1 CH3COONH4��Һ����0.1 mol��L��1 NH4HSO4��Һ����0.1 mol��L��1��ˮ ��0.1 mol��L��1 NH3��H2O��0.1 mol��L��1 NH4Cl���Һ
�����Ҫ����д���пհף�
(1)��Һ�ٳ�_______(������������������������)�ԣ���ԭ����___________(�����ӷ���ʽ��ʾ)��
(2)����5����Һ�У�����ˮ�ĵ���̶�������_______(�����)
(3)�������١��ڡ��ۡ�����Һ��c(NH4+)Ũ���ɴ�С��˳����_____________��(�����)
(4) �����£������Һ�ڵ�pH��7����CH3COO����NH4+Ũ�ȵĴ�С��ϵ��c(CH3COO��)______c(NH4+)(��������������������=��)��
(5)�ñ�������Һ�ζ�δ֪Ũ�ȵİ�ˮʵ�顣�ζ���ѡ�õ�ָʾ��Ϊ_______(������������ ����̪��)�������ζ���ʼʱ�ζ��ܼ��촦�����ݣ����ʱ�ζ��ܼ��촦�������ݣ���ᵼ�µζ����______(����ƫ������ ��ƫ����)��
���𰸡��� NH4+��H2O![]() NH3��H2O��H�� �� �ۣ��٣��ڣ��� �� ���� ƫ��
NH3��H2O��H�� �� �ۣ��٣��ڣ��� �� ���� ƫ��
��������
(1)�Ȼ����ǿ�������Σ�笠�����ˮ������һˮ�ϰ��������ӣ���Һ�����ԣ�
(2)��0.1 mol��L-1 NH4Cl��ҺΪ����笠�����ˮ�⣬ˮ�ĵ����ܵ��ٽ��������Һ����������笠����ӵ�ˮ���Ӱ�����ˮ�ĵ���̶ȵı仯��
(3)��0.1 mol��L-1 NH4Cl��ҺΪ����������Һ����������笠����ӵ�ˮ���Ӱ�죬��������ˮ��̶Ⱥ�������ʵĵ���̶�һ�����С��������
(4)�����£������Һ�ڵ�pH=7��˵����Һ��c(OH-)=(H+)�����ݵ���غ�����жϣ�
(5)�ñ�������Һ�ζ�δ֪Ũ�ȵİ�ˮ���ζ��յ������Ȼ�泥���Һ�����ԣ���Ҫѡ�������������±�ɫ��ָʾ�����ζ���ʼʱ�ζ��ܼ��촦�����ݣ����ʱ�ζ��ܼ��촦�������ݣ����¶�ȡ�ı���Һ�����ƫС���ݴ˷����жϡ�
(1)�Ȼ����ǿ�������Σ�笠�����ˮ�⣬��Һ�����ԣ�ˮ������ӷ���ʽΪ��NH4++H2O![]() NH3H2O+H+���ʴ�Ϊ���NH4++H2O
NH3H2O+H+���ʴ�Ϊ���NH4++H2O![]() NH3H2O+H+��
NH3H2O+H+��
(2)�Ԣ�0.1 mol��L-1 NH4Cl��ҺΪ����笠�����ˮ�⣬ˮ�ĵ����ܵ��ٽ�����0.1 mol��L��1 CH3COONH4��Һ�����������ˮ�⣬�ٽ�笠�����ˮ�⣬ˮ�ĵ���̶�����0.1 mol��L��1 NH4HSO4��Һ������������笠�����ˮ�⣬�������H+����ˮ�ĵ��룬��0.1 mol��L��1��ˮ�������Լ��ԣ�ˮ�ĵ����ܵ����ƣ���0.1 mol��L��1 NH3��H2O��0.1 mol��L��1 NH4Cl���Һ��һˮ�ϰ�������笠����ӵ�ˮ�⣬ˮ�ĵ���̶ȼ�С�����ˮ�ĵ���̶������Ǣڣ��ʴ�Ϊ���ڣ�
(3)��0.1 mol��L-1 NH4Cl��Һ��笠�����ˮ�⣬c(NH4+)��С��0.1 mol��L-1����0.1mol/L CH3COONH4 ���������ˮ��ٽ�笠�����ˮ�⣬笠�����Ũ��С�ڱȢ�С����0.1mol/L NH4HSO4 ��Һ�е�����������笠����ӵ�ˮ�⣬笠�����Ũ�ȱȢٴ�0.1 mol��L��1��ˮ��һˮ�ϰ����ֵ��룬c(NH4+)ԶС��0.1 mol��L-1�����c(NH4+)Ũ���ɴ�С��˳��Ϊ���ʴ�Ϊ���ۣ��٣��ڣ��ܣ�
(4)�����£������Һ�ڵ�pH=7��˵��0.1mol/L CH3COONH4 ��Һ�д�������Ӻ�笠�����ˮ��̶���ͬ����Һ�д��ڵ���غ㣺c(CH3COO-)+c(OH-)=c(NH4+)+c(H+)��pH=7˵����Һ��c(OH-)=(H+)����c(CH3COO-)=c(NH4+)���ʴ�Ϊ��=��
(5)�ñ�������Һ�ζ�δ֪Ũ�ȵİ�ˮ���ζ��յ������Ȼ�泥���Һ�����ԣ���ѡ�ü�����ָʾ�����ζ���ʼʱ�ζ��ܼ��촦�����ݣ����ʱ�ζ��ܼ��촦�������ݣ����¶�ȡ�ı���Һ�����ƫС���ζ����ƫ�ͣ��ʴ�Ϊ�����ȣ�ƫ�͡�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��KMnO4����ѧ������ǿ���������ù�������������Ʊ�KMnO4�����̺ͷ�Ӧԭ����ͼ��

��Ӧԭ����
��ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
��Ӧ��3K2MnO4+2CO2�T2KMnO4+MnO2��+2K2CO3
��ī��ɫ�� ���Ϻ�ɫ��
��֪25�����ʵ��ܽ��g/100gˮ
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
��ش�
��1�����в�����������ȷ����___
A����Ӧ���ڴ������н��У����ò���������
B����������HCl�������CO2����
C�����ò�����մȡ��Һ����ֽ�ϣ�����ֽ��ֻ���Ϻ�ɫ������ɫ�ۼ�����Ӧ����ȫ
D�������������Ũ������Һ�����о�Ĥ��������ȴ�ᾧ�����ʱ�¶Ȳ��ܹ���
��2��___����������������������ͨ�����CO2���壬������___���û�ѧ����ʽ�ͼ�Ҫ����˵������
��3���������Ӧ�ò�����ά������ֽ���г��˲�����������___��
�����Ƶζ�������������ش��Ȳ������£�
��ȡ1.6000g������ز�Ʒ�����100mL��Һ
��ȷ��ȡ����0.5025g�Ѻ�ɵ�Na2C2O4��������ƿ�У�������������ˮʹ���ܽ⣬�ټ������������ữ��
����ƿ����Һ���ȵ�75��80�棬������I�����Ƶĸ��������Һ�ζ����յ㡣
��¼ʵ���������
ʵ����� | �ζ�ǰ����/mL | �ζ������/mL |
1 | 2.65 | 22.67 |
2 | 2.60 | 23.00 |
3 | 2.58 | 22.56 |
��֪��MnO4��+C2O42��+H+��Mn2++CO2��+H2O��δ��ƽ��
��KMnO4�Ĵ���Ϊ___��������λ��Ч���֣������ζ����Ӷ����������___������ƫ��������ƫ����������Ӱ��������
����Ŀ��(1)��ͼ����ʵ�飬��a��Һ����ʢb��Һ���Թ��У�д���Թ��й۲쵽������Ӧ�����ӷ���ʽ��
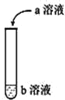
a | b | �Թ������� | ���ӷ���ʽ |
Na2CO3 | ϡ���� | ________________ | _________ |
ϡ���� | Na2CO3 | ______________ | _______________ |
(2)��ҵ������NaIO3��NaHSO3��Ӧ����ȡ����I2����ƽ���л�ѧ����ʽ���õ����ŷ���ʾ����ת�Ƶķ������Ŀ��
_____NaIO3+_____NaHSO3��_____I2+_____Na2SO4+_____H2SO4+_____H2O
(3)ClO2������ˮ�ľ�������ҵ�Ͽ���Cl2����NaClO2��Һ��ȡ![]() ��д���÷�Ӧ�����ӷ���ʽ������˫���ŷ���ʾ����ת�Ƶķ������Ŀ_____________________��
��д���÷�Ӧ�����ӷ���ʽ������˫���ŷ���ʾ����ת�Ƶķ������Ŀ_____________________��
����Ŀ��һ������Na2CO3��NaHCO3�ľ��Ȼ����ֳ��������ȵ����ݣ��ֱ���50mL��ͬŨ�ȵ����ᷴӦ���õ��������������������������ϵ���±���ʾ��
�顡�� | 1 | 2 | 3 |
��������/g | 3.80 | 6.20 | 7.20 |
��������/g | 1.76 | 2.64 | 2.64 |
(1)�ϱ���_______�����ݱ�������μӷ�Ӧ����ʣ�࣬������______________��
(2)�ϱ��е�2������������____________��������������������������������������
(3)ͨ��������Na2CO3��NaHCO3������������Ϊ_________��____________��
����Ŀ��������A��B���ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A��g����B��g��![]() 2C��g����2D��g������Ӧ���е�10 sĩ�����A�����ʵ���Ϊ1.8 mol�� B�����ʵ���Ϊ0.6 mol��C�����ʵ���Ϊ0.8 mol����
2C��g����2D��g������Ӧ���е�10 sĩ�����A�����ʵ���Ϊ1.8 mol�� B�����ʵ���Ϊ0.6 mol��C�����ʵ���Ϊ0.8 mol����
��1����C��ʾ10 s�ڷ�Ӧ��ƽ����Ӧ����Ϊ__________��
��2����ӦǰA�����ʵ���Ũ����__________��
��3��10 sĩ��������D��Ũ��Ϊ________��
��4�����ı���������������D��������α仯����������������С��������������գ���
��� | �ı������ | ����D������ |
�� | �����¶� | _______ |
�� | ����A��Ũ�� | _______ |
�� | ʹ�ô��� | _______ |
�� | �����³���Ne����������ϵ��Ӧ�� | _______ |