题目内容
【题目】按要求填空。
(1)![]() 的核外电子排布式:________________________ 。
的核外电子排布式:________________________ 。
(2)![]() 的价电子排布式:________________________ 。
的价电子排布式:________________________ 。
(3)![]() 的电子式:________________________ 。
的电子式:________________________ 。
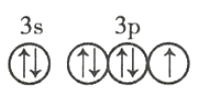
(4)![]() 的价电子轨道表示式: ________________________ 。
的价电子轨道表示式: ________________________ 。
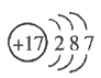
(5)![]() 的原子结构示意图: ________________________ 。
的原子结构示意图: ________________________ 。
(6)第四周期中最外层只有1个电子的所有基态原子的简化电子排布式:________________。
【答案】![]()
![]()
![]()
![]()
【解析】
(1)![]() 的核外共有17个电子,电子排布式为
的核外共有17个电子,电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;
(2)![]() 的价电子为其最外层电子,价电子排布式为
的价电子为其最外层电子,价电子排布式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)![]() 的最外层有8个电子,其电子式为
的最外层有8个电子,其电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)![]() 的价电子轨道表示式为
的价电子轨道表示式为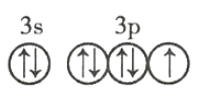 ,故答案为
,故答案为 ;
;
(5)![]() 的原子结构示意图为
的原子结构示意图为 ,故答案为:
,故答案为: ;
;
(6)第四周期中最外层只有1个电子的原子有K、Cr、Cu,它们的简化电子排布式分别为:![]() ,故答案为:
,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】在一定温度下,将气体X和气体Y 各0.16mol 充入 10L 恒容密闭容器中,恒容器闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
2Z(g) △H<0,一段时间后达到平衡,反应过程中测定的数据如表,下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)mol | 0.12 | 0.11. | 0.10 | 0.10 |
A.反应前 2min 的平均速率 v(Z)=2.0×10-3mol·L-1min-1
B.其他条件不变,向平衡体系中再充入0.16mol 气体 X,与原平衡相比,达到新平衡时,气体 Y 的转化率增大,X 的体积分数增大,Z 的体积分数减少
C.其他条件不变,降低温度,反应达到新平衡前 v (逆)>v(正)
D.保持其他条件不变,起始时向溶液中充入0.32mol气体X 和0.32mol 气体 Y,到达平衡时,n(Z)<0.24mol
【题目】下列事实与原因对应关系不正确的是
A | B | C | D | |
物质 |
Na2FeO4 |
海水稻 |
金属铜 |
碳酸钠 |
事实 | 用于自来水净水消毒 | 海水稻的秸杆可以燃烧发电 | Cu作原电池的电极 | 制革工业中原料皮的脱脂 |
主要原因 | Na2FeO4有强氧化性且能在水中产生胶体 | 稻子的秸杆中蕴含生物质能 | Cu能导电且质稳定 | Na2CO3稳定性强 |
A.AB.BC.CD.D
【题目】已知元素的电负性和原子半径一样,也是元素的基本性质。下表给出14种元素的电负性:
元素 | AL | B | Be | C | Cl | F | Li | Mg | N | Na | O | P | S | Si |
电负性 | 1.5 | 2.0 | 1.5 | 2.5 | 3.0 | 4.0 | 1.0 | 1.2 | 3.0 | 0.9 | 3.5 | 2.1 | 2.5 | 1.8 |
试结合元素周期律相关知识完成下列问题。
(1)根据上表给出的数据,可推知元素的电负性具有的变化规律是__________ (从电负性与结构的关系考虑)。
(2)请预测Br与I元素电负性的大小关系:_________ 。
(3)经验规律告诉我们:当成键的两原子相应元素的电负性差值大于1.7时,一般为离子键,而小于1.7时,一般为共价键。试推断![]() 中化学键的类型是 ___________
中化学键的类型是 ___________
(4)预测元素周期表中电负性最小的元素是_____ (放射性元素除外)。