题目内容
【题目】有五种短周期元素,它们的结构、性质等信息如下表所示:
元素 | 结构、性质等信息 |
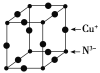
A | 是短周期元素(稀有气体元素除外)中原子半径最大的元素,含该元素的某种合金是原子反应堆的导热剂 |
B | 与A同周期,其最高价氧化物对应的水化物呈两性 |
C | 其气态氢化物极易溶于水,液态时常用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的杀菌消毒剂 |
E | 元素原子的L电子层上有2对成对电子 |
请根据表中信息回答下列问题。
(1)A元素原子的核外电子排布式为___。
(2)B元素在元素周期表中的位置为___;离子半径:B___(填“>”或“<”)A。
(3)C元素原子的轨道表示式为___,其原子核外有___个未成对电子,能量最高的电子排布在轨道上,该轨道呈___形。
(4)D元素原子的核外电子排布式为___,D-的结构示意图为___。
(5)C、E元素的第一电离能的大小关系是___(用元素符号表示)。
(6)已知CD3分子中D元素显+1价,则该情况下,C、D元素的电负性大小关系是CD3___(用元素符号表示),CD3与水反应后的产物是___(填化学式)。
【答案】1s22s22p63s1(或[Ne]3s1) 第三周期第ⅢA族 < ![]() 3 哑铃 1s22s22p63s23p5(或[Ne]3s23p5)
3 哑铃 1s22s22p63s23p5(或[Ne]3s23p5) 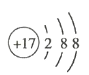 N>O N>Cl NH3(或NH3·H2O)和HClO
N>O N>Cl NH3(或NH3·H2O)和HClO
【解析】
短周期元素中,A是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂,则A为Na;B与A同周期,其最高价氧化物的水化物呈两性,则B为Al;C元素的气态氢化物极易溶于水,可用作制冷剂,则C为N元素;D是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂,则D为Cl,E是L层上有2对成对电子,则E为O,据此分析解答。
(1)A为Na,其核外电子排布式为1s22s22p63s1或[Ne]3s1;
(2)B为Al,其在元素周期表中的位置为第三周期第ⅢA族,Na+与Al3+的核外电子排布相同,核电荷数:Al3+>Na+,故离子半径:Al3+<Na+;
(3)C为N,其原子的轨道表示式为![]() ,其中有3个未成对电子,能量最高的电子排布在p轨道上,该轨道呈哑铃形;
,其中有3个未成对电子,能量最高的电子排布在p轨道上,该轨道呈哑铃形;
(4)D为Cl,其核外电子排布式为1s22s22p63s23p5或[Ne]3s23p5,Cl-的结构示意图为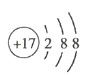 ;
;
(5)N、O分别位于第ⅤA族、第ⅥA族,因为N的2p轨道处于半充满状态,比较稳定,故第一电离能:N>O;
(6)NCl3分子中N显-3价,Cl显+1价,故N的电负性大于Cl,NCl3的水解产物为NH3(或NH3·H2O)和HClO。

【题目】类推的思维方法在化学学习与研究中常会产生错误的结论,因此类推的结论最终要经过实践的检验才能确定其正确与否。下表中有关推论正确的是( )
已知事实 | 推论 | |
A | 氯乙烷能发生消去反应 | 所有的卤代烃都能发生消去反应 |
B | 乙烯分子内所有原子在同一平面上 | 丙烯分子内所有原子在同一平面上 |
C | 乙烯在空气中燃烧有黑烟 | 苯在空气中燃烧产生的烟更浓 |
D | 烷烃的含碳量随碳原子数的增大而增大 | 炔烃的含碳量随碳原子数的增大而增大 |
A.AB.BC.CD.D