题目内容
【题目】海水中有丰富的化学资源,从海水中可提取多种化工原料。
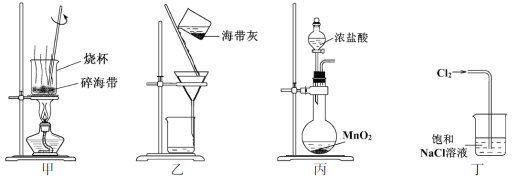
以下为工业从海水中提取液溴的流程图如下,已知:溴的沸点为59 ℃,微溶于水,有毒性。
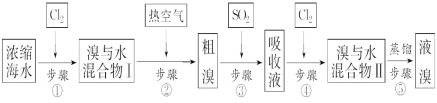
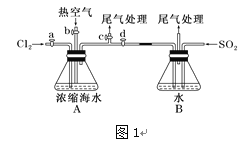
(1)某同学利用“图1”装置进行实验,当进行步骤①时,应关闭活塞___,打开活塞______。
(2)步骤③中反应的离子方程式____________________________。
(3)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是________________________。
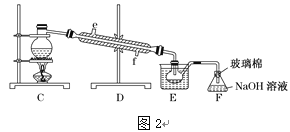
(4)步骤⑤用“图2”装置进行蒸馏,C处蒸馏烧瓶中已加入碎瓷片,尚未安装温度计,此外装置C中还有一处,改进后效果会更好,应该如何改进_____________________________。
【答案】bd ac SO2 + Br2 + 2H2O=SO42- + 4H+ +2Br— 浓缩Br2或富集溴 直接加热改为水浴加热
【解析】
步骤①时,通入氯气,与海水中的溴离子反应生成单质溴,溴的沸点为59 ℃,再通入热空气,把生成的溴单质吹出,溶于水制取粗溴;在粗溴中通入二氧化硫生成硫酸和溴离子,再经过氯气氧化得到较纯的溴水,经过蒸馏得到液溴。
(1)通入氯气的目的是将溴离子氧化为单质溴,故此时应关闭活塞bd,打开活塞ac,并进行尾气处理;
(2)步骤③中用二氧化硫吸收溴单质,生成硫酸和溴化氢,离子方程式为SO2 + Br2 + 2H2O=SO42- + 4H+ +2Br—;
(3)用热空气把“溴水混合物Ⅰ”的溴吹出,经过一些操作到“溴水混合物Ⅱ”的目的是浓缩溴或富集溴;
(4) 已知,溴的沸点为59 ℃,采用水浴加热的方式蒸馏效果更好。

练习册系列答案
 名师指导一卷通系列答案
名师指导一卷通系列答案
相关题目